Йерун Коле и Ноэлия Муньос-Мартин
Конфокальная микроскопия с вращающимся диском (SDC) стала очень популярной среди исследователей клеточной биологии, поскольку она обеспечивает хорошее разрешение и высокую скорость сбора данных, что позволяет изучать динамические биологические процессы. Однако его возможности ограничены при визуализации толстых образцов из-за перекрестных помех. Это явление возникает, когда расфокусированный свет проходит через окружающие точечные отверстия, ограничивающие конфокальность. Кроме того, слабые сигналы плохо детектируются SDC, так как через диск проходит только 10 % света. Это означает, что обычно мощность лазера необходимо увеличивать, чтобы получить лучшее отношение сигнал/шум (SNR), что вредно для долговременной визуализации живых клеток.
Эксперты Confocal.nl разработали альтернативное решение с выдающейся производительностью во время экспериментов с глубокой трехмерной визуализацией живых клеток. Конфокальная система NL5 обеспечивает высокую скорость сбора данных (25 кадров в секунду), высокое разрешение и контрастность и подходит для живых клеток. В целом это делает NL5 хорошей альтернативой для преодоления ограничений SDC и лучшим вариантом для изучения динамических процессов. На рисунке ниже сравниваются SDC с NL5 Confocal.nl во время глубокой 3D-визуализации. Видно, что производительность NL5 во время длительных экспериментов по визуализации живых клеток намного выше.
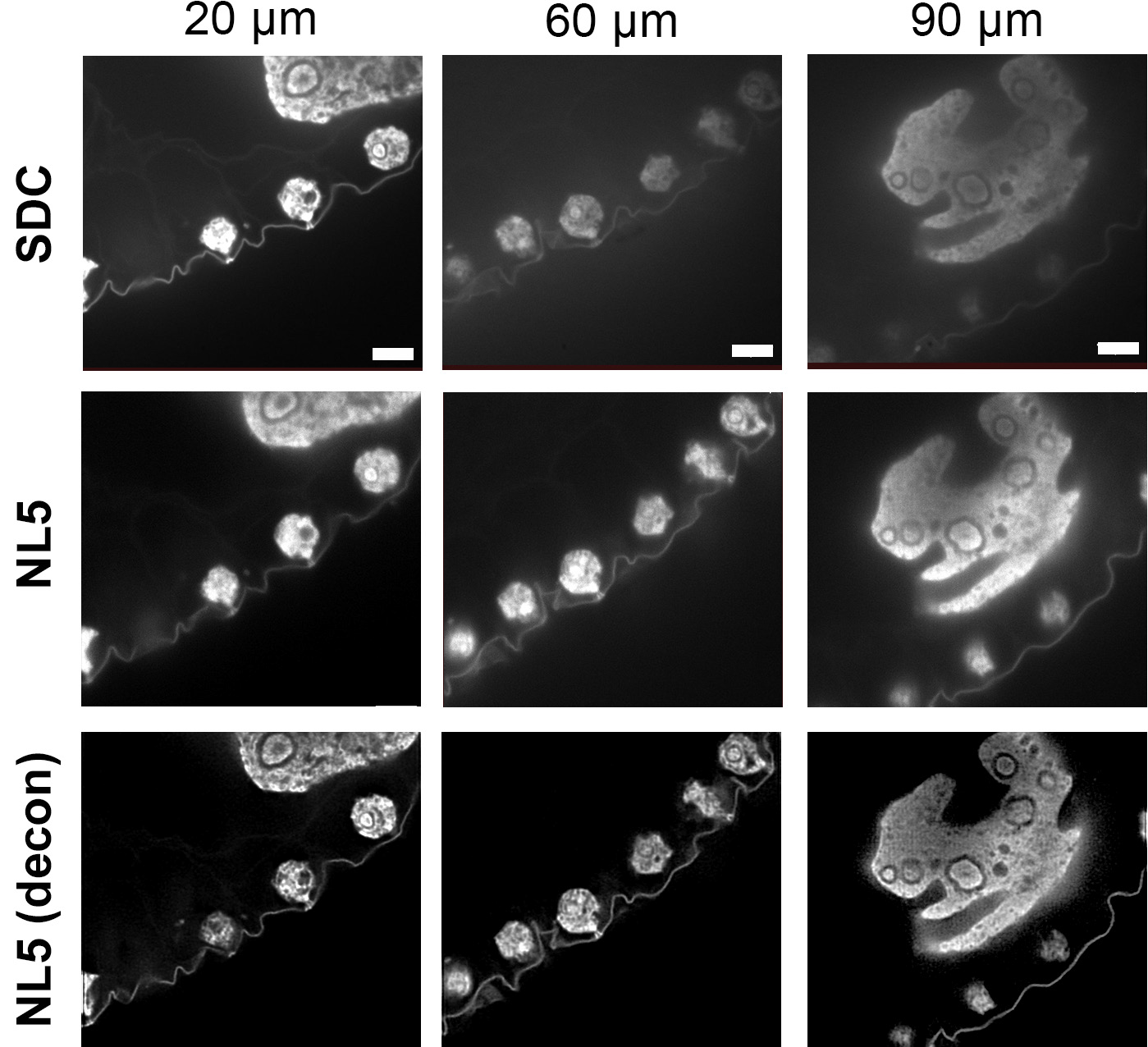
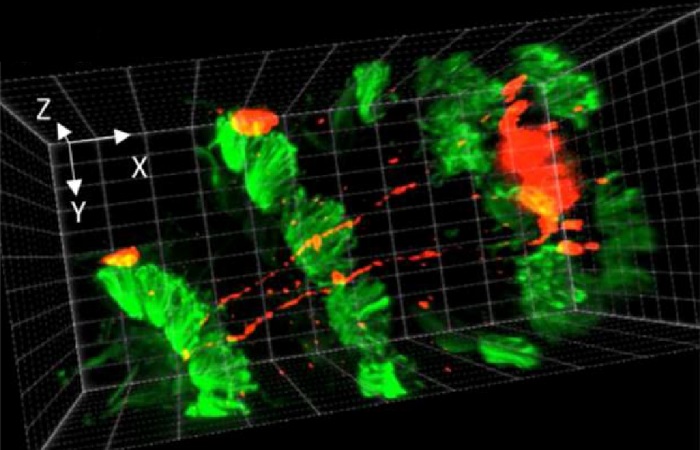
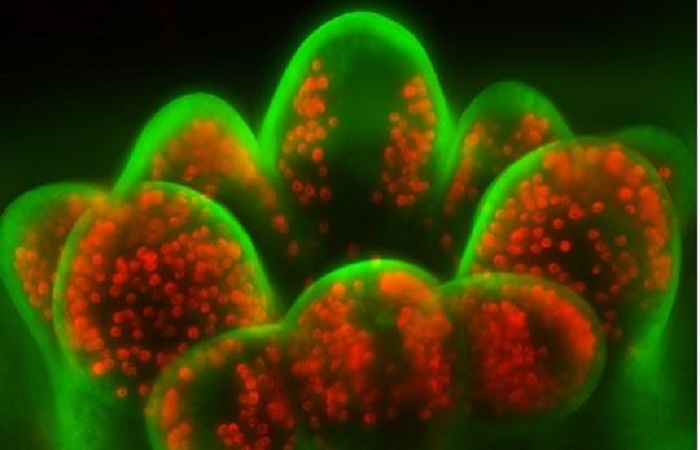
Рисунок 1. Изображения Volvox, полученные с помощью SDC и NL5. На первом и втором ряду фотографий показано сравнение одной и той же конфокальной плоскости Volvox, полученной с помощью SDC и NL5. На третьем ряду показаны изображения NL5 после деконволюции. Серый цвет: автофлуоресценция Volvox. Масштабная линейка: 5 мкм
Материалы и методы
Для получения изображения образца Volvox использовали микроскоп Nikon TiE с масляным объективом CFI Plan Apo Lambda 100X 1,45NA. Визуализация SDC выполнялась с помощью хорошо известного устройства с вращающимся диском. Для обоих наборов данных использовалась камера Hamamatsu sCMOS. Автофлуоресценцию возбуждали с помощью лазера с длиной волны 561 нм. Z-интервал был установлен на 200 нм. Для измерения мощности лазера в плоскости образца использовался датчик Thorlabs S170C.

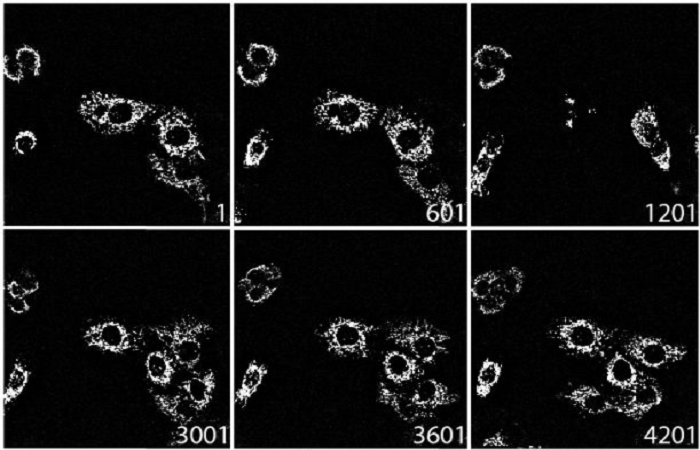
Рисунок 2. 24-часовая визуализация живых клеток эмбриона рыбки данио с использованием NL5. Слева направо: 5 изображений формирования сосудистой сети у эмбриона в течение 24 часов (~ 6 часов между каждым изображением). Белые квадраты обозначают увеличение области, показанной на панели ниже. Зеленый цвет: эндотелиальные клетки, меченные эндогенным GFP. Масштабная линейка: 200 мкм
Набор данных для образца данио был получен с помощью микроскопа Olympus IX83 с объективом X-Line 10x 0,45 NA. GFP возбуждали с помощью лазера с длиной волны 488 нм. Z-стеки размером 540 микрометров с интервалами в 5 микрометров снимались каждые 10 минут в течение 24-часового промежутка времени.
NL5 обеспечивает лучшее отношение сигнал-шум и меньше размытых изображений, чем SDC, при визуализации толстых образцов.
Результаты
NL5 демонстрирует лучшую производительность, чем SDC, во время экспериментов с глубокой трехмерной визуализацией
Водоросли Volvox использовались для получения трехмерных конфокальных срезов фиксированного образца с использованием его автофлуоресценции. Системы NL5 и SDC были соединены с одним и тем же микроскопом и камерой. SDC продемонстрировал конфокальное разрешение и хорошее отношение сигнал-шум в срезах, близких к покровному стеклу (от 1 до 20 мкм) (рис. 1). Однако в следующих разделах представлено большее размытие, плохое отношение сигнал-шум и меньшее разрешение. Этот эффект был еще более заметен в самых глубоких секциях стека при 90 мкм (рис. 1).
С другой стороны, NL5 продемонстрировал такое же разрешение и SNR, что и SDC, в срезах, расположенных ближе к покровному стеклу, но он продемонстрировал лучшие результаты в более глубоких срезах (от 20 до 90), демонстрируя более высокое SNR и меньшее размытие (рис. 1). Для дальнейшего улучшения разрешения была применена деконволюция с использованием Microvolution и PSF, разработанных для NL5 (рис. 1). Из-за высокой контрастности изображений деконволюция была оптимальной, достигнуто латеральное разрешение 170 нм.
NL5 требует меньшей мощности лазера, чем SDC, для превосходного SNR
Высокая интенсивность лазера вредна для живых клеток, она вызывает фототоксичность и изменяет поведение живых образцов, что приводит к менее биологически значимым результатам. Кроме того, если для достижения адекватного SNR необходима высокая интенсивность лазера, флуорофоры можно быстро обесцвечивать. Известно, что SDC использует меньшую интенсивность лазера, чем стандартные конфокальные приборы с точечным сканированием, но при использовании SDC могут быть поставлены под угрозу долгосрочные эксперименты по визуализации живых клеток. Здесь мы измерили мощность лазера и дозу света, использованную во время получения трехмерного изображения Volvox (таблица 1). Образец Volvox, полученный с помощью NL5, имел в 16 раз меньшую дозу света по сравнению с SDC. Эта разница в интенсивности лазера в плоскости образца улучшит результаты экспериментов по визуализации живых клеток.
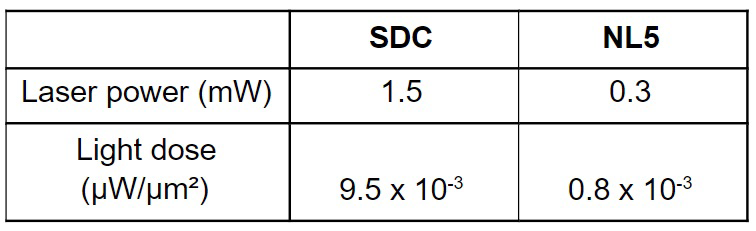
Таблица 1. Мощность лазера и доза света, измеренные в плоскости образца при визуализации с помощью SDC и NL5.
Чтобы продемонстрировать возможности конфокального модуля NL5 для долговременной визуализации живых клеток, эмбрион рыбки данио визуализировали в течение 24 часов. Эндотелиальные клетки метили эндогенным GFP, что позволяло визуализировать формирование сосудов у эмбриона. Как и ожидалось, на всем протяжении сосуда с образцом происходило прорастание (рис. 2). Сосредоточившись на мозге, ученые смогли наблюдать за формированием функциональных сосудов и за тем, как отдельные клетки делятся, перемещаются и взаимодействуют друг с другом в течение всего времени. В заключение, никаких признаков фототоксичности обнаружено не было, а отношение сигнал-шум было хорошим на протяжении всего эксперимента, без признаков обесцвечивания.
Выводы
Эти эксперименты показали превосходную производительность NL5 по сравнению с SDC во время глубокой 3D-визуализации. NL5 захватывает более качественные изображения с низким SNR и с меньшим размытием, чем SDC, при глубине образца более 20 мкм. Высококонтрастные изображения, полученные с помощью NL5, были оптимальны для деконволюции, увеличивая поперечное разрешение изображений до 170 нм.
Кроме того, в NL5 использовалась меньшая мощность лазерного возбуждения, чем в SDC, чтобы получить лучшее соотношение сигнал-шум для того же образца. Это представляет собой большое преимущество для экспериментов по визуализации живых клеток, как это было также доказано экспериментом с рыбками данио. Эмбрион рыбки данио (24 часа с момента оплодотворения) сохраняли живым под микроскопом в течение 24 часов, при этом было получено в общей сложности 18000 изображений. Развитие эмбриона не было изменено, признаков фототоксичности или обесцвечивания не наблюдалось. Это показывает, что NL5 является хорошей системой для долгосрочных экспериментов по визуализации живых образцов. Таким образом: NL5 обеспечивает высокую скорость сканирования, отсутствие фототоксичности, высокое разрешение и отношение сигнал/шум, отличные возможности трехмерной визуализации.