Вступление
SRRF-Stream компании Andor - это модуль для микроскопии сверхвысокого разрешения в реальном времени, который предлагается в качестве расширения функционала EMCCD камер iXon Life и iXon Ultra с чувствительностью на уровне одиночных фотонов. Функция SRRF-Stream позволяет использовать для флуоресцентной микроскопии сверхвысокого разрешения в режиме реального времени практически любой современный микроскоп при измерениях со стандартными флуорофорами в условиях низкого уровня освещенности. Это делает представленную технологию полностью совместимой с системами визуализации живых клеток, при этом разрешение изображений возрастает в 2-6 раз (максимальное разрешение 50-150 нм).
Являясь экспертом в технологиях оптимизации работы GPU, компания Andor ускорила SRRF алгоритм в 30 раз по сравнению с существующим решением постобработки данных на базе ImageJ (NanoJ-SRRF). Такое ускорение значительно оптимизирует рабочий процесс за счет запуска процессов сбора и обработки данных в параллельном режиме. Так как обработка происходит быстрее, чем камера может регистрировать данные, функция SRRF-Stream теперь работает в режиме реального времени с большими изображениями со сверхвысоким разрешением.
Благодаря этой особенности функция SRRF-Stream позволяет исследователям напрямую оптимизировать настройки получаемого изображения одновременно c визуализацией изображений со сверхвысоким разрешением, что является преимуществом по сравнению с другими методами получения сверхвысокого разрешения, основанными на постобработке данных, где только получение конечных изображений со сверхвысоким разрешением занимает от нескольких часов до нескольких дней после визуализации исследуемого образца.
Технология SRRF-Stream также широко применяется для микроскопии живых клеток с использованием мощностей возбуждения флуоресценции в диапазоне от мВт/см2 до Вт/см2. Таким образом, удалось получить высокопроизводительную микроскопию сверхвысокого разрешения при ≥ 106 раз меньшей мощности возбуждения по сравнению с методами получения сверхвысокого разрешения, основанных на локализации. Кроме того, может быть достигнута скорость получения изображения сверхвысокого разрешения, превышающая 10 кадров в секунду, и демонстрация изображения в режиме реального времени, что означает, что можно отслеживать даже быстропротекающие физиологические процессы с высокой разрешающей способностью. Изображения больших полей обзора со сверхвысоким разрешением также могут быть получены в режиме реального времени, благодаря чему можно просматривать большие поля клеток, но с внутриклеточным разрешением, которое позволяет легко различить внутреннюю структуру суборганелл.
Ключевые особенности технологии SRRF-Stream:
- Съемка в режиме реального времени - расширенный рабочий процесс, исключающий постобработку изображений. Просмотр событий в режиме реального времени.
- Сверхвысокое разрешение - улучшение в 2-6 раз (окончательное разрешение 50-150 нм).
- Работает с очень низким уровнем возбуждения - длительные наблюдения живых клеток и точная физиология.
- Обычные флуорофоры, например, GFP - не требуется создание эффекта фотопереключения.
- Динамика живых клеток - полнокадровое изображение генерируется каждые 1-2 секунды, при использовании небольших областей интереса частота может быть увеличена до > 10 Гц.
- Экономически эффективный метод - преобразование обычных флуоресцентных микроскопов в микроскопы со сверхвысоким разрешением: широкопольный, TIRF, конфокальный.
Алгоритм метода SRRF
Метод радиальных флуктуаций (SRRF - произносится как «Surf») - это объединение анализа временных флуктуаций и локализационной микроскопии. Одно из ключевых отличий между методом SRRF и другими способами получения сверхвысокого разрешения заключается в возможности его использования для визуализации динамики живых клеток, потому что он применим в очень широком диапазоне плотностей флуорофоров и мощностей возбуждения. Алгоритм SRRF был разработан группой Рикардо Энрикеса в UCL [1]. Он анализирует радиальные и временные флуктуации интенсивности флуоресценции в последовательности изображений. Количество «входных» изображений в последовательности может варьироваться для достижения оптимального соотношения между пространственным и временным разрешением. Это может быть особенно важно для исследований, проводимых на живых клетках, где фототоксичность должна быть сведена к минимуму, а иногда и требуется регистрация быстрых физиологических процессов.

Рисунок 1 – Технология SRRF-Stream легко создает полнокадровые изображения со сверхвысоким разрешением с высокой частотой кадров. Структура микротрубочек в флуоресцентно меченных клетках BPAE (эндотелиальные клетки легочной артерии крупного рогатого скота) в сравнении с широкопольным изображением с использованием и без использования функции SRRF-Stream. Изображения были получены с помощью EMCCD камеры iXon Ultra 888 с полным полем зрения 1024 x 1024 пикселей. Использовался 63-кратный объектив с высокой числовой апертурой с дальнейшим 2-кратным увеличением и подсветкой с длиной волны излучения 560 нм. Были получены 100 необработанных «входных» изображений для каждого последующего результирующего изображения со сверхвысоким разрешением, в результате чего скорость кадров изображения с супер-разрешением составила 0,5 Гц. Для честного сравнения без функции SRRF-Stream были записаны и усреднены 100 стандартных широкопольных изображений. Для функции SRRF-Stream использовалось 4-кратное радиальное увеличение, что позволило получить изображение со сверхвысоким разрешением размером 4096x4096 пикселей.
Метод SRRF использует концепцию полей радиальности [3] как первый важный шаг к достижению сверхвысокого разрешения. По своей сущности этот метод анализирует градиенты интенсивности через определенный пользователем набор радиалов, пересекающих центральную точку анализа. Анализируются такие радиальные градиенты в каждой точке получаемого изображения, обычно при интерполированном определяемом пользователем разрешении, которые больше, чем собственное пиксельное разрешение используемой камеры. В результате образуется очень сложный набор данных, который содержит обширную информацию о локальных градиентах интенсивности. Это, в свою очередь, дает подробную информацию о точном расположении флуорофоров в конкретном получаемом изображении.
Тем не менее, для метода SRRF требуется, чтобы несколько изображений (обычно 50-100) были получены и расположены в последовательности необходимой для получения одного выходного изображения сверхвысокого разрешения. Такие методы стохастического флуктуационного анализа (SFA), включая как SRRF, так и SOFI [2], зависят от анализа (короткого) временного ряда изображений с относительно коротким временем экспозиции и быстрой выборкой. Значение, присвоенное выходному пикселю, зависит от исходной яркости и корреляции флуоресцентных флуктуаций в пикселе. Фон имеет тенденцию быть плохо коррелированным и поэтому можно получить значительный выигрыш в контрасте.
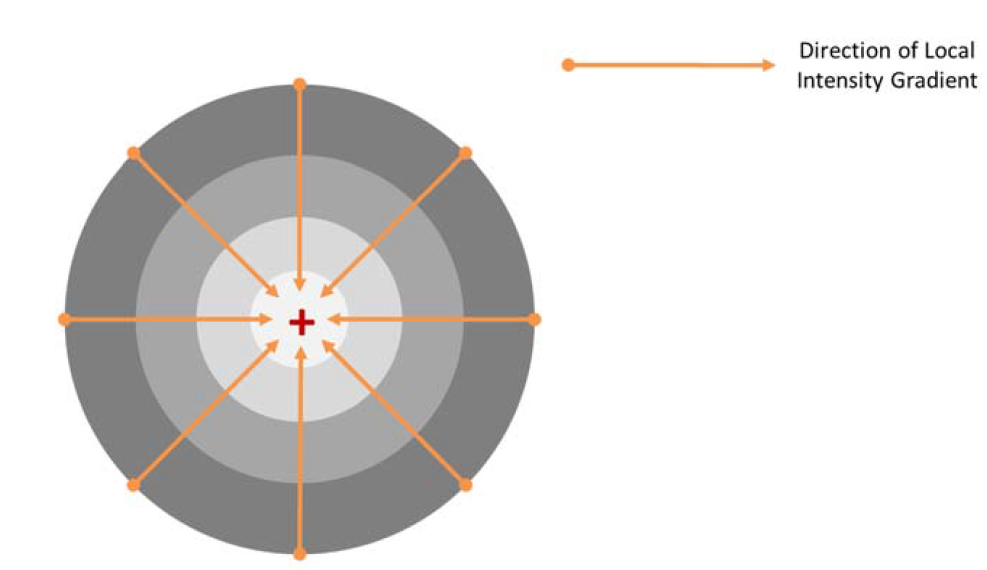
Рисунок 2 - Диаграмма, представляющая упрощенный вид одиночного флуорофора и направления градиентов локальной радиальной интенсивности. Флуоресцентный маркер находится в центре поля градиента интенсивности, он же является точкой максимальной радиальной симметрии.
В методе SOFI улучшенное разрешение можно получить путем вычисления кумулянтов более высокого порядка. В методе SRRF улучшение разрешения достигается за счет непрерывной интерполяции поля радиальности. Методы SFA обрабатывают высокие плотности флуорофоров, что делает технологию SRRF применимой к широкопольным, конфокальным и TIRF изображениям с относительно низкой интенсивностью возбуждения.

Рисунок 3 - Этапы алгоритма метода SRRF. Левая сторона рисунка показывает одно широкопольное необработанное изображение плотного набора данных, полученного с мощностью возбуждения флуоресценции всего лишь 40 мВт/см2. Правая сторона рисунка показывает преобразование. На вставке показан результат Стохастического Флуктуационного Анализа 100 изображений с радиальным преобразованием, полученных соответственно из 100 необработанных широкопольных изображений. Таким образом, вставка демонстрирует качество конечного выходного изображения сверхвысокого разрешения, полученного методом SRRF.
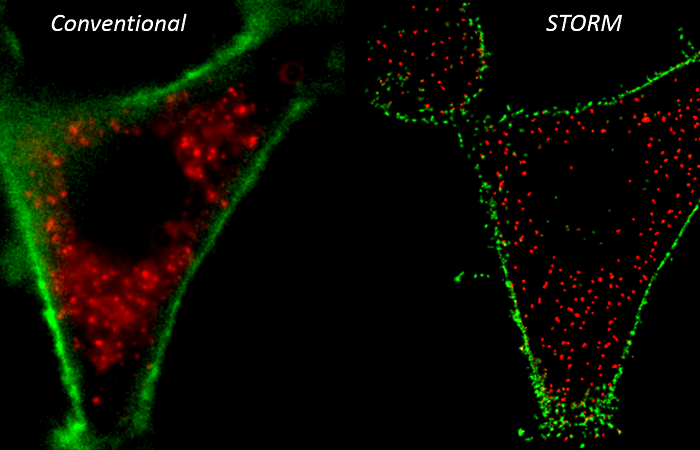
Метод SRRF легко применяется к массивам данных полученных из режимов визуализации, которые включают в себя широкопольную, TIRF и конфокальную микроскопию, где короткие пакеты кадров (например, 50-100 кадров) могут быть обработаны, чтобы обеспечить пространственное разрешение, сходное или лучшее, чем достигается при структурированной световой микроскопии (SIM) [4], что обычно составляет от 50 до 150 нм. Когда технология SRRF-Stream используется с разреженными наборами данных, например, данные типа STORM [5], метод SRRF обеспечивает разрешение, аналогичное гауссовым методам локализации, обеспечивающие разрешение менее 50 нм. Таким образом, метод SRRF обеспечивает высокую гибкость и адаптацию к достижению сверхвысокого разрешения без необходимости использования специального оптического оборудования или экзотических датчиков, и использования относительно низких плотностей мощности возбуждения флуоресценции.
Реализация SRRF-Stream метода компанией Andor
Работая в плотном сотрудничестве с лабораторией Рикардо Энрикеса, группой количественной визуализации и нанобиофизики в UCL, компания Andor полностью адаптировала технологию SRRF-Stream для ее оптимальной работы на новых камерах iXon EMCCD. Являясь экспертом в технологиях оптимизации работы GPU, компания Andor ускорила SRRF алгоритм в 30 раз по сравнению с существующим решением постобработки данных на базе ImageJ (NanoJ-SRRF). Такое ускорение значительно оптимизирует рабочий процесс за счет запуска процессов сбора и обработки данных в параллельном режиме. Так как обработка происходит быстрее, чем камера может регистрировать данные, функция SRRF-Stream теперь работает в режиме реального времени с большими изображениями со сверхвысоким разрешением. Полнокадровое изображение со сверхвысоким разрешением генерируется EMCCD камерой с частотой > 1 Гц, при использовании ROI частота может быть увеличена до > 10 Гц.

Рисунок 4 - Этот график сравнивает скорость обработки блоков из 100 необработанных входных изображений (1024 x 1024 пикселей), чтобы получить результирующие SRRF изображения со сверхвысоким разрешением 4096 x 4096 пикселей. Технология SRRF-Stream сравнивается с NanoJ-SRRF, обработка происходит на той же видеокарте Nvidia GTX 1070. Ускорение SRRF-Stream впоследствии позволяет собирать и обрабатывать данные в параллельном режиме, обеспечивая дальнейшее улучшение рабочего процесса по сравнению с методом NanoJ-SRRF.
Измерение быстрых процессов в живых клетках с помощью технологии SRRF-Stream
Некоторые процессы в живых клетках, такие как митоз, могут отслеживаться с использованием визуализации в режиме таймлапса, и камера может легко работать с полным разрешением пикселей в сочетании с оптимальными настройками для достижения наилучшего сверхвысокого разрешения, сохраняя при этом необходимую частоту кадров. Даже при комбинировании многоцветной визуализации и визуализации z-стеков в режиме таймлапса со сверхвысоким разрешением могут быть получены относительно большие размеры изображения.
Однако для некоторых физиологических процессов может потребоваться несколько SRRF кадров в секунду. Так как частота кадров с функцией SRRF-Stream ограничена камерой, то жертвуя широким полем обзора и/или количеством входных кадров на выходное SRRF-изображение, можно получить пропорциональное увеличение частоты кадров. Кроме того, использование специальной функции EMCCD камеры iXon под названием «Режим кадрирования» (Crop Mode) в сочетании с областью интересов, дает значительное увеличение частоты кадров. Обратите внимание, что режим кадрирования «обманывает» сенсор, заставляя его думать, что он меньше, чем есть на самом деле, и, следовательно, он игнорирует необходимость считывания и сброса заряда с пикселей, которые окружают указанную область интереса ROI. Таким образом, режим кадрирования должен использоваться в сочетании с простым дополнительным режимом работы камеры, который называется «OptoMask» для того, чтобы оптически защитить соседние области за пределами определенной области интереса от фотонов, которые в противном случае будут искажать получаемое изображение.
В приведенной ниже таблице показана частота кадров изображения сверхвысокого разрешения с функцией SRRF-Stream, достигаемая для EMCCD камеры iXon 888 при различных комбинациях размера области интереса (стандартная область интереса и область исследования в режиме кадрирования) и входных кадров на выходном изображении сверхвысокого разрешения. Например, при области интереса размером 128x128 пикселей камеры iXon 888, используемой в режиме кадрирования, и 50 входных кадров на одно выходное изображение (таким образом, жертвуя некоторой степенью разрешающей способности), получается скорость 14 кадров в секунду, что более чем достаточно для отслеживания большинства динамических процессов в живых клетках. Также обратите внимание, что если 4-кратное увеличение используется в режиме SRRF-Stream (по умолчанию), то область интереса 128x128 пикселей становится изображением со сверхвысоким разрешением размером 512x512 пикселей.
Таблица 1 - Частота кадров изображения сверхвысокого разрешения с функцией SRRF-Stream, достигаемая для EMCCD камеры iXon 888 при различных комбинациях размера области интереса (стандартная область интереса и область исследования в режиме кадрирования) и количества входных кадров для каждого изображения сверхвысокого разрешения
Стандартный режим области интереса
|
Размер области интереса камеры iXon 888 |
Скорость кадров камеры – стандартная область интереса ROI, к/c |
Скорость кадров с функцией SRRF-Stream – 100 входных кадров, к/с |
Скорость кадров с функцией SRRF-Stream – 50 входных кадров, к/с |
|
512х512 |
50 |
0.5 |
1.0 |
|
256х256 |
95 |
1.0 |
1.9 |
|
128х128 |
171 |
1.7 |
3.4 |
Область интереса в режиме кадрирования
|
Размер области интереса камеры iXon 888 |
Скорость кадров камеры – режим кадрирования области интереса ROI, к/c |
Скорость кадров с функцией SRRF-Stream – 100 входных кадров, к/с |
Скорость кадров с функцией SRRF-Stream – 50 входных кадров, к/с |
|
512х512 |
78 |
0.8 |
1.6 |
|
256х256 |
251 |
2.5 |
5.0 |
|
128х128 |
697 |
7 |
14 |
Оптимальные критерии визуализации для SRRF-Stream
Метод SRRF дает лучшие результаты, если исходные изображения получены с частотой Найквиста или близко к ней, независимо от того будь то использование широкопольных, конфокальных или TIRF режимов. Для камер с относительно большим размером пикселя, таких как EMCCD камера iXon 897 или iXon 888 от Andor в идеальном случае это может потребовать дополнительного увеличения, доступного либо с помощью объектива в микроскопе или адаптера для С-mount со встроенным увеличением. В таблице ниже приведен пример комбинации увеличения объектива и увеличения адаптера, приводящие к различной степени передискретизации предела разрешения. Идеальная передискретизация составляет 2.3 или более, но обратите внимание, что условия до 1.5 могут все еще адекватно использоваться для получения хороших результатов с алгоритмом SRRF.
Таблица 2 - Примеры комбинаций увеличения объектива и увеличения адаптера, приводящие к различной степени передискретизации
|
Камера |
Область интереса |
Размер пикселя, мкм |
Увеличение объектива |
Числовая апертура |
Увеличение соединения |
Предел разрешения сенсора – правило Релея |
Выборка Найквиста (предел разрешения + размер пикселя) |
|
iXon 897 |
512х512 |
16 |
100 |
1.49 |
1 |
24.56 |
1.5 |
|
512х512 |
16 |
100 |
1.49 |
1.5 |
36.85 |
2.3 | |
|
512х512 |
16 |
60 |
1.4 |
1.5 |
23.53 |
1.5 | |
|
512х512 |
16 |
60 |
1.4 |
2 |
31.37 |
2.0 | |
|
iXon 888 |
1024х1024 |
13 |
100 |
1.49 |
1 |
24.56 |
1.9 |
|
1024х1024 |
13 |
100 |
1.49 |
1.5 |
36.58 |
2.8 | |
|
1024х1024 |
13 |
60 |
1.4 |
1.5 |
23.53 |
1.8 | |
|
1024х1024 |
13 |
60 |
1.4 |
2 |
31.37 |
2.4 |
Применения SRRF-Stream
Благодаря своей способности преодолевать классический дифракционный предел в микроскопии и, кроме того, достигать этого в реальном времени, благодаря несложной маркировке образцов, использованию типового оборудования и низкоинтенсивного освещения, технология SRRF-Stream дает возможность исследовать ранее невиданные клеточные структуры и поведение при беспрецедентном пространственно-временном разрешении с низким фотоповреждением.
Какие возможности для наблюдения за исследуемыми образцами открывает технология SRRF-Stream?
- Анализ структуры белка на уровне суборганелл;
- Отслеживание отдельных молекул внутри клеток;
- Использование этого отслеживания, чтобы получить представление об отдельных молекулярных механизмах, лежащих в основе клеточной физиологии;
- Благодаря этой информации, обновление модели клеточных функций.
Пример применения технологии SRRF-Stream:
- Мембранный синтез с использованием отдельных белковых механизмов SNARE;
- Динамические изменения внутри синаптических везикул;
- Реформация дендритных шипов за счет синаптической пластичности и их изучение;
- Процессы передачи сигнала и межклеточная коммуникация и дифференциация;
- Флуктуации структуры ДНК, включая экспрессию и ингибирование;
- Сборка внутриклеточного скелета - изменения в структуре актиновых волокон.
Что нужно для работы с SRRF-Stream?
Технология SRRF-Stream оптимизирована для работы с EMCCD камерами iXon Life и iXon Ultra (модели 897 и 888) компании Andor, как на НОВЫХ камерах, так и в качестве ОБНОВЛЕНИЯ к уже существующим у пользователя камерам.
НОВЫЕ EMCCD камеры серии iXon - iXon Life и iXon Ultra, которые заказываются пользователем для поставки с функцией SRRF-Stream, специальным образом настраиваются для совместимости и оптимальной работы с SRRF-Stream. При заказе новой камеры, также следует заказывать функцию SRRF-Stream, фактически как дополнительный аксессуар к EMCCD камере. После получения заказа специалисты компании Andor проведут настройку каждой камеры и оптимизируют ее для работы с функцией SRRF-Stream перед отправкой клиенту вместе с программой установки SRRF-Stream и лицензией. Заказ новой EMCCD камеры iXon с функцией SRRF-Stream - лучший способ обеспечить абсолютно оптимальное качество изображения изображений, обработанных технологией SRRF-Stream.
Чтобы получить доступ к SRRF-Stream необходимо следующее:
- EMCCD камера Andor iXon Life или iXon Ultra совместимая с функцией SRRF-Stream;
- Лицензия SRRF-Stream и установочная программа (позволяет использовать функцию SRRF-Stream в камере при наличии специального серийного номера камеры),
- Видеокарта NVidia GPU (CUDA-совместимая)*;
- Пакет программного обеспечения MicroManager или Andor SDK2,
- Флуоресцентный микроскоп совместимый с широкопольной, TIRF или конфокальной микроскопии с вращающимся диском.
Примечание - * Карта Nvidia GPU должна иметь Compute Capability v3.0 или выше и оперативную память встроенного графического процессора в размере 4 ГБ или выше. Обратите внимание, что компания Andor провела обширное тестирование с использованием карты GTX 1070 «среднего уровня» и обнаружила, что функция SRRF-Stream обрабатывает данные намного быстрее, чем скорость сбора данных камеры iXon.
Обратите внимание, что компания Andor также предоставляет рабочую станцию с рекомендованной и протестированной видеокартой, с установленной функцией SRRF-Stream, а также программным обеспечением MicroManager с поддержкой SRRF-Stream и набором разработчика Andor SDK2 с SRRF-Stream.
Настройки SRRF-Stream
Стандартные настройки функции SRRF-Stream в программном обеспечении MicroManager обычно дают фантастическое улучшение разрешения получаемого изображения. Тем не менее, пользователь может свободно проводить различные эксперименты с доступными настройками SRRF-Stream:
Тип интерполяции: Сплайновые кривые Катмулл-Рома является используемым по умолчанию типом интерполяции и имеет тенденцию создавать превосходное разрешение получаемого изображения. Вам понадобится только альтернативный тип B-сплайн, если по какой-то причине Вы столкнулись с проблемой скорости обработки, но так как даже с GPU-картами среднего уровня функция SRRF-Stream обрабатывает изображение гораздо быстрее, чем камера iXon может получать данные, поэтому, как правило, в этом нет необходимости.
Количество кадров в момент времени: Как правило, 100 входных кадров дают превосходное улучшение разрешения. Однако, если Вы хотите следить за динамическими событиями и ограничены частотой кадров камеры, то Вы, конечно, можете использовать меньше входных кадров. Даже используя всего лишь 20-30 кадров, можно получить улучшенное разрешение, хотя на практике минимум «50» кадров следует считать «безопасным» нижним пределом.
Увеличение радиальности: Радиальность рассчитывается по сетке увеличенных пикселей; настройка увеличения радиальности определяет, на сколько увеличенных пикселей делится каждый исходный пиксель изображения. Например, увеличение радиальности в 5 раз разделит каждый пиксель изображения на 5x5 увеличенных пикселей. Вообще повышение увеличения радиальности улучшит разрешающую способность, но это будет не линейная зависимость, а случайное предельное дальнейшее усиление при более высоких увеличениях. Платой за повышение увеличения является рост времени, затраченного на вычисления. Увеличение в 4 раза по умолчанию дает очень хорошее разрешение, но не стесняйтесь экспериментировать с этим коэффициентом, тем более что функция SRRF-Stream очень эффективна при обработке данных. Обратите внимание, что если оригинальное разрешение камеры составляет 1024x1024 пикселей и радиальное увеличение 4, то выходное изображение, обработанное функцией SRRF-Stream, будет иметь размер 4096x4096 пикселей.
Кольцевой радиус: Чтобы рассчитать радиальность для каждой координаты на получаемом изображении, методу SRRF необходимо рассчитать градиенты интенсивности в кольце, окружающем каждую координату. Настройка радиуса кольца определяет радиус этого кольца. Для наборов данных с низкой плотностью установка этого радиуса на минимальный уровень увеличит разрешение получаемого изображения; однако установка слишком большого радиуса в зашумленных наборах данных снизит точность и может привести к формированию шаблонов в получаемом изображении. Стоит поэкспериментировать с этой настройкой на разных типах образцов, если Вы чувствуете, что необходимо попробовать еще улучшить изображение, но по умолчанию значение равное 0,5, является оптимальным параметром и будет часто давать лучшие результаты.
Тип временного анализа: Временной анализ определяет метод, которым комбинируется окончательное изображение после расчета радиального преобразования. При настройке по умолчанию «Среднее» (Mean) конечное изображение отображается как проекция средней интенсивности радиальности, которая преобразует каждый отдельный кадр в исходное изображение. Часто это хорошая отправная точка для анализа, особенно для мигающих наборов данных, в которых флуорофоры перекрываются, или для наборов данных, полученных там, где флуорофоры отображают ограниченные флуктуации интенсивности, такие как обычная TIRF или широкопольная микроскопия.
Настройка «MIP» отображает окончательное изображение в виде проекции максимальной интенсивности радиальных преобразований каждого индивидуального кадра в исходном изображении. Эта опция наиболее успешно работает для разреженных наборов данных, т.е. в классических PALM/STORM экспериментах.
Улучшение разрешения с помощью SRRF-Stream
Следующие изображения, все из которых были получены с использованием технологии Andor SRRF-Stream, способны продемонстрировать впечатляющее улучшение разрешения, которое может быть легко достигнуто.

Рисунок 5 - Сравнение изображений флуоресцентно меченной клетки BPAE (эндотелиальная клетка легочной артерии крупного рогатого скота), записанной с помощью широкопольного флуоресцентного микроскопа и EMCCD камеры iXon Life 888 с функцией SRRF-Stream. Использовался 63-кратный объектив с дальнейшим 2-кратным увеличением и подсветкой с длиной волны 560 нм. 100 необработанных «входных» изображений были записаны для каждого результирующего изображения с высоким разрешением, в результате чего скорость изображения сверхвысокого разрешения составила 0.5 Гц. Для достоверного сравнения без функции SRRF-Stream были сделаны и затем усреднены 100 стандартных широкоформатных изображений. В то время как исходное изображение было с большим полем клеток, увеличенная область интереса одной клетки показано здесь для того, чтобы легко показать сравнение линии профиля интенсивности в небольшой области. Улучшение в разрешающей способности очевидно.

Рисунок 6 – Сравнение стандартного широкопольного изображения и широкопольного изображения с функцией SRRF-Stream тромбоцитов крови, красной мембраны, зеленой внутренней гранулы. Образец предоставлен лабораторией Катлера в UCL.

Рисунок 7 - Сравнение флуоресцентно меченной клеточной линии U2OS*, зарегистрированной с помощью конфокального флуоресцентного микроскопа с вращающимся диском Andor Dragonfly и EMCCD камерой iXon Life 888 с функцией SRRF-Stream. Использовался 63-кратный объектив с дальнейшим 2-кратным увеличением и подсветка с длиной волны 488 нм. Беспрецедентное улучшение разрешающей способности может наблюдается на уровне детализации в митотическом веретене. Это также подтверждается сравнением линии профиля интенсивности, проходящей через эту область изображения.
Примечание: *Клеточная линия U2OS была зафиксирована, окрашена первичным антителом против альфа-тубулина (зеленый, AF488) и фаллоидином (красный, родамин) для визуализации F-актина, DAPI окрашивание для визуализации ядер. Образцы предоставлены А. Клебановичем, лаборатория биологии цитоскелета, IMG AS CR.
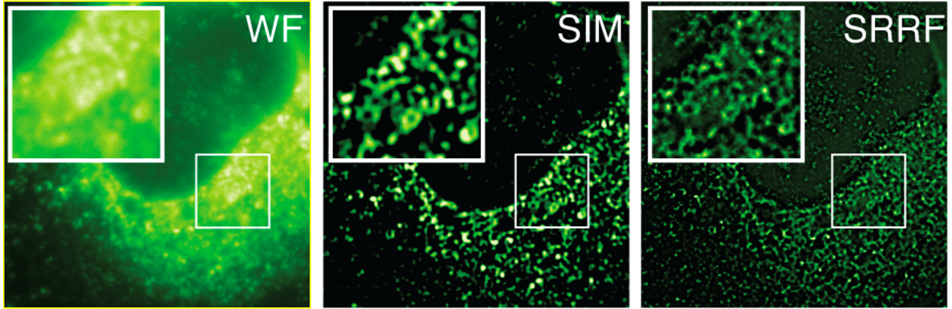
Рисунок 8 - Инфицированные HCV-клетки (гепатит С), окрашенные ингибитором белка NS5A. Сравнение изображений, полученных методами широкопольной микроскопии (WF), микроскопии структурированного освещения (SIM) [4] и методом SRRF (SRRF широкопольное изображение). Изображения имеют одинаковое клеточное поле, записанное на одном и том же микроскопе, используя одинаковый объектив и оптический путь. Единственная разница в том, что SIM-изображение было получено с использованием sCMOS камеры с размером пикселя 6.5 мкм, в то время как WF- и SRRF-изображения были записаны с использованием EMCCD камеры Andor iXon с размером пикселя 16 мкм. Превосходная разрешающая способность метода SRRF очевидна, что свидетельствует о том, что SRRF позволяет получить более чем двукратное улучшение разрешения по сравнению с классическим дифракционным пределом. Микроскопия структурированного освещения (SIM) теоретически ограничена двухкратным уменьшением классического дифракционного предела. Образец предоставлен лабораторией Грува в UCL.

Рисунок 9 - Сравнительные изображения покрытых клатрином ямок живых клеток HeLa, меченных флуорофором mCherry, записанных на широкопольном микроскопе со скоростью 2 кадра в секунду. 100 необработанных «входных» изображений были записаны для каждого результирующего изображения с высоким разрешением, в результате чего скорость изображения со сверхвысоким разрешением составила 2 кадра в секунду. Линии профиля интенсивности показаны проведенными через небольшую область изображения обработанного функцией SRRF-Stream, показывающие разрешение структур, которые находятся на расстоянии 150 нм друг от друга. Образцы предоставлены Карэн Якобс (лаборатории Рикардо Энрикеса и Марка Марша в UCL).
Приложение 1: Оптимизация производительности SRRF-Stream
Следует отметить, что иногда функция SRRF-Stream может приводить к появлению двух типов артефактов в изображении:
1) «Теневая область» в непосредственной близости от наблюдаемых клеточных структур
2) «Звездообразный» рисунок на изображении при достаточном увеличении
Пример артефакта типа 1 можно увидеть на паре изображений, приведенных ниже - эффект затенения обозначен красными стрелками в нескольких областях вдоль четко очерченных краев гребней тубулина, которые видны на снимке с электронным умножением (EM). Это вызвано алгоритмом SRRF и тем, как он работает с информацией об интенсивности, содержащейся в оригинальном изображении. Алгоритм рассматривает локальную окрестность видимой особенностью, в данном случае волокнами тубулина, чтобы выявить наличие областей, характеризующихся высокой вероятностью нахождения флуорофоров, расположенных там, и, в свою очередь, по их высокой локальной радиальности.
Всякий раз, когда Вы переходите между локальной областью с высокой вероятностью присутствия флуорофора и, следовательно, с высокими радиальными флуктуациями и областью слабого присутствия или отсутствия флуорофора, алгоритм SRRF использует переход между такими высокими и низкими областями для создания контрастной информации. Или, другими словами, метод SRRF более уверен в том, что флуорофоры НЕ присутствуют в этой области, когда они близко расположены к областям, где флуорофоры присутствуют в большом количестве. Это создает так называемый «эффект затенения», который Вы видите вблизи структур. Важно признать, что этот эффект затенения будет проявляться только на истинном фоне, поэтому не будет отрицательно сказываться на количественной целостности данных. Например, если было две рядом друг с другом расположенные микротрубочки, то одна из них не будет подвержена влиянию контрастной тени другой, так как алгоритм SRRF просто не обнаружил бы достаточную информацию о контрасте для создания эффекта тени в первом месте.
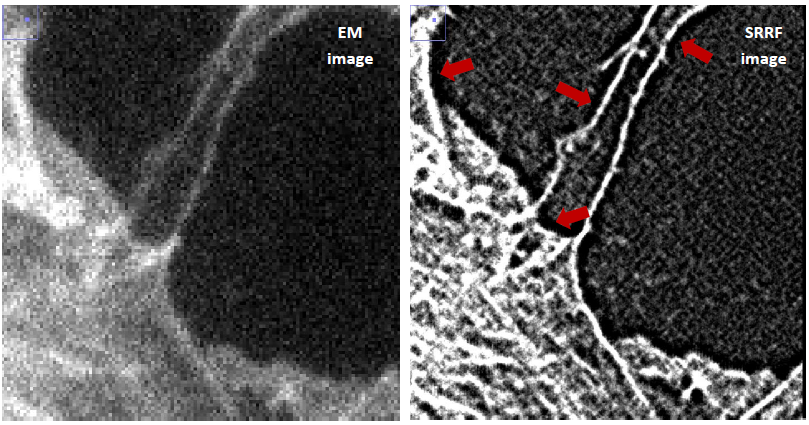
Артефакт типа 2 - это звездообразный узор, появляющийся по краям объектов, как показано на среднем рисунке ниже. Этот артефакт становится особенно очевидным, когда Ваша исследовательская установка не была оптимизирована под увеличение объектива, его числовую апертуру и размер пикселя камеры и, следовательно, существует недостаточная выборка. Другими словами - чем дольше не выполняется критерий Найквиста, тем более заметным становится этот артефакт. Простое решение противодействовать возникновению данного артефакта - увеличить радиус кольца в настройках SRRF. Тем не менее, это компромиссное решение – артефакт изображения в форме звезды будет подавлен, но ценой незначительного ухудшения разрешения. Вы можете видеть это ниже на правой части изображения, где радиус кольца был увеличен со значения по умолчанию 0,5 до 1,0. Если шаблон сохраняется, то Вы можете увеличить это значение еще до 1,5 при постепенном ухудшении разрешения.
Приложение 2: Рабочая станция для SRRF-Stream
Рабочая станция Andor SRRF-Stream настроена и протестирована специалистами компании Andor для обеспечения оптимального соотношения цена/качество для использования функции SRRF-Stream с EMCCD камерами iXon Ultra и iXon Life (модели «888» и «897»). Рабочая станция поставляется с предустановленной последней версией программного обеспечения MicroManager (64-разрядная версия) и обновленной версией набора разработчика Andor SDK2 (64-разрядная версия) и включает в себя рекомендованную CUDA-совместимую видеокарту NVidia, способную обеспечить в режиме реального времени запись изображений сверхвысокого разрешения в сочетании с высокоэффективной технологией SRRF-Stream от Andor. В качестве альтернативы, Вы можете использовать спецификацию рабочей станции и видеокарты пакета SRRF-Stream от Andor как руководство по настройке и заказу Вашей собственной рабочей станции через независимых поставщиков, если этот вариант поставки предпочтительнее. Тем не менее, обратите внимание, что такая конфигурация рабочей станции самостоятельной сборки не будет технически поддерживаться компаний Andor.
Подробная спецификация рабочей станции пакета SRRF-Stream (код изделия Andor: MSC-13069):
• Корпус Dell Precision Tower 5810 XCTO Base
• Процессор Intel Xeon E5-1630 v3 (четырехъядерный HT, 10 МБ кэш-памяти, 3,7 ГГц Turbo)
• Корпус Dell Precision Tower 5810 685 Вт TPM, версия 2, BW
• 16 ГБ (4x4 ГБ) 2400 МГц DDR4 RDIMM ECC
• Нет чтения карт памяти
• Жесткий диск 500 ГБ 7200 об/мин
• 2 дополнительных жестких диска Serial-ATA (7200 об/мин) емкостью 500 ГБ
• Встроенный SATA-контроллер набора микросхем Intel AHCI (6 x 6,0 Гбит / с) - SW RAID 0/1/5/10
• 512 ГБ Adata DP900 SSD 2,5 дюйма с интерфейсом SATA 6 Гбит / с, MTBF 1 час HS {CS]
• Радиатор для одного процессора T5810
• 8x Slimline DVD +/- RW дисковод
• 1 NVIDIA Quadro M4000 8 ГБ (4 DP) (переходник 1 DP к SL-DVI)
• Внутренний динамик
• Оптическая мышь Dell MS116 Black
• Мультимедийная клавиатура Dell - Великобритания (QWERTY) - черный
• C4 SATA / SSD 2,5 дюйма, 3-4 жестких диска (встроенный контроллер)
• DVD Dell Precision
• Windows 10 Pro 64bit English, Dutch, French, German, Italian
• Windows 10 Pro OS Recovery 64bit - DVD
• McAfee Security Center 30 day trial, Digital Delivery
Дополнительно
• Dell UltraSharp U3417W - изогнутый светодиод 34,14" (код изделия Andor: FUS-MNTR-34W)
или же
• Dell Dell UltraSharp UP3017 - 30 "с PremierColor (код изделия Андор: FUS-MNTR-30)
Литература
1. Gustafsson N., Culley S., et al (2016) Nat. Comms.
2. Dertinger T., et al (2009) PNAS
3. Parthasarathy R. (2012) Nat. Meth.
4. Gustafsson M.G.L. (1999) J. Microsc.
5. Bates M.J., et al (2008) Science