Шунтаро Ямада, Бергенский университет
Современное развитие технологий визуализации с высоким разрешением позволяет исследователям визуализировать субмикронные структуры или даже наноструктуры в интересующих их клетках и тканях с помощью иммунофлуоресцентного окрашивания. Однако, это уже требует тщательной подготовки образцов, чтобы получить четкие изображения, кроме того, протоколы могут становится более требовательными по мере увеличения разрешения изображения.
Хотя «оптимальные» протоколы и предоставляются различными производителями антител, к сожалению, не существует стандартной процедуры, применимой ко всем типам образцов. Действительно, большую часть времени исследователям приходится находить наилучший рабочий процесс путем проб и ошибок. Теоретически протоколы иммунофлуоресцентного окрашивания состоят из следующих шести основных этапов: фиксация, пермеабилизация, блокировка, инкубация с первичными и вторичными антителами и получение изображения. Тем не менее, на каждом этапе есть много мелких деталей, которые, будучи выполненными тем или иным образом, могут повлиять на то, получите вы хорошее или плохое иммунофлуоресцентное изображение.
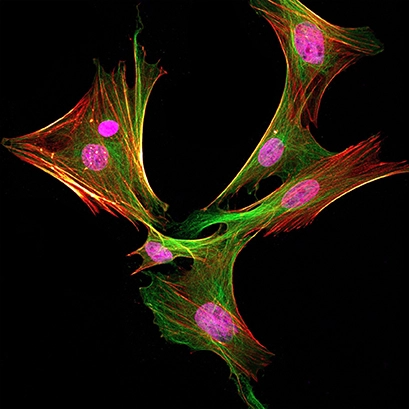
Мезенхимальные стволовые клетки костного мозга крысы Льюис окрашивали антителами против кроличьего PCNA (показаны пурпурным цветом), антителами против альфа-тубулина (показаны зеленым цветом) и фаллоидином (показаны красным цветом). Изображение получено с помощью конфокального микроскопа Leica SP8.
С тех пор, как я вошел в исследовательскую среду в качестве магистра наук в 2017 году, я работал с различными типами мезенхимальных стволовых клеток и эмбриональных тканей, чтобы исследовать черепно-лицевую регенерацию и развитие. Кроме того, я погрузился в мир иммунофлуоресцентного окрашивания и сделал бесчисленное количество изображений. Потратив около 300 часов в год на флуоресцентную визуализацию, я нашел идеальный протокол иммунофлуоресценции для своих клеток и приложений. Я узнал, что даже небольшие изменения в процессе действительно имеют значение! Шунтаро Ямада, Бергенский университет
1. Выберете целевой белок и определите протокол фиксации
Первая важная рекомендация, которой необходимо следовать, это решить, какой фиксатор использовать для ваших образцов. Различные фиксаторы, в том числе альдегиды (например, параформальдегид: PFA), спирт (например, охлажденный метанол) и растворы на основе кислот (например, трихлоруксусная кислота), показали превосходную совместимость с иммунофлуоресценцией, однако каждый из этих фиксаторов имеет свои преимущества и недостатки. PFA и метанол являются хорошими кандидатами для начала.
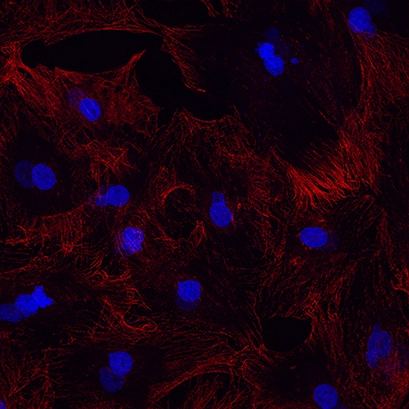
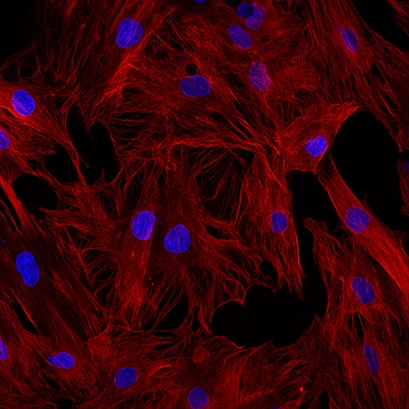
Независимо от того, какой фиксатор вы выберете, крайне важно оптимизировать продолжительность фиксации. Следует избегать чрезмерной фиксации, так как она оказывает деструктивное воздействие на клетки и ухудшает распознавание антител (рис. 1А). Тем не менее, следует также избегать недостаточной фиксации, так как это позволяет вашему целевому белку перемещаться из его нативных участков и диффузировать во «внешний мир». Это приводит не только к размытым изображениям, но и к ложноположительному окрашиванию.
|
Рис. 1A: Пример чрезмерной фиксации. Метанол использовали в течение 15 минут при комнатной температуре. Альфа-тубулин красным цветом и ядра, DAPI синим цветом. |
Рис. 1B: Пример правильно фиксированных клеток: Ледяной метанол в течение 5 минут при температуре -20 градусов. Альфа-тубулин выделен красным цветом, а ядра, DAPI выделены синим цветом. |
2. Выбор детергента и момента его использования (или отказ от него)
Когда требуется пермеабилизация, неионогенные детергенты (например, Triton X-100 и Tween-20) обычно включают не только в пермеабилизирующий буфер, но также часто в блокирующий буфер, буфер для промывки и буфер для окрашивания. Это связано с тем, что использование детергента фактически повышает эффективность блокирования и устраняет неспецифическое связывание антител во время этапов промывки. Однако, если ваш целевой белок, особенно на клеточной мембране или цитоскелете, проявляется на ваших изображениях в меньшем количестве, чем вы ожидали, детергент может мешать иммуноокрашивание. В конце концов, не забывайте, что иногда детергент вообще не нужен.
3. Низкая концентрация, но долгая инкубация
Использование наименьшего необходимого количества антител чрезвычайно важно для увеличения отношения сигнала к фону. Я всегда рекомендую определять самую низкую рабочую концентрацию с помощью титрования антител, даже если оптимальная концентрация может быть предложена производителем. Как правило, более длительная инкубация (например, при 4°C в течение ночи) с низкой концентрацией антител обеспечивает более четкое, сильное и специфичное окрашивание по сравнению с более коротким временем инкубации с высокой дозой антител. Титрование антител иногда трудоемко и требует дополнительных ресурсов и времени, но вы не пожалеете об этом, как только определите оптимальную рабочую концентрацию.
4. Промывать, промывать и еще раз промывать
Промывание, вероятно, является наиболее важным этапом в процессе иммунофлуоресцентного окрашивания. Поверьте, о дополнительных этапах промывки никогда не жалеют! Пока используется высококачественное антитело, связывание антиген-антитело достаточно сильное, чтобы выдержать «дополнительные» этапы промывки, которые в то же время эффективно удаляют слабо или неспецифически связанные антитела. С ваших губ может вот-вот сорваться тихий шепот: «Это отнимает много времени и монотонно». Я знаю, но промывка действительно превращает ваши изображения из хороших в великолепные! Добавьте еще один или два этапа промывки, чтобы у вас было время насладиться чашечкой чая.
5. Найдите правильное оптическое оборудование
И последнее, но не менее важное: мельчайшие детали изображений фиксируются только тогда, когда все оптические системы хорошо оптимизированы. Если вы занимаетесь фотографией, вы, возможно, знаете, что объективы высокого класса часто стоят дороже, чем сама камера (например, сенсорная система). Это просто потому, что на разработку тонкого стекла и покрытия было потрачено очень много ресурсов и времени. Можно сказать, что качество этих объективов определяет качество изображения. Та же теория применима и к микроскопическим системам. Оптические системы микроскопа являются ключевым фактором, определяющим качество конечного изображения. Забавный факт: это компонент, из-за которого производители микроскопов яростно конкурируют друг с другом, чтобы продвигать свои технологии!
Теперь я слышу, как вы говорите: «Мы не можем изменить оптическую систему нашего микроскопа». На самом деле есть кое-что, что вы можете изменить, что существенно повлияет на результаты визуализации независимо от вашего технического оборудования: посуда для визуализации, которую вы используете для культивирования или размещения клеток и образцов! Эти компоненты, сделанные из тонкого стекла или пластика, полностью прозрачны для человеческого глаза, но каждый из них — там, где проходит свет/лазер — существенно повлияет на окончательный результат изображения, как если бы они были частью вашей оптической системы.
Вот где слайд-камеры Ibidi µ-Slide вступают в игру! Камеры и покровные стекла Ibidi µ-Slide были разработаны для обеспечения превосходного оптического качества для микроскопии высокого разрешения благодаря тонкому дну покровного стекла. Для стандартной визуализации клеток с высоким разрешением (например, фазово-контрастной, конфокальной или двухфотонной) я настоятельно рекомендую модели посуды ibidi из полимера, обработанного клеточной культурой (ibiTreat), с толщиной покровного стекла #1.5 (180 мкм), или модели м дном из стекла #1.5H (170 мкм +/-5 мкм), идеально подходящие для TIRF и микроскопии сверхвысокого разрешения.
Я познакомился с посудой ibidi в начале своего докторского проекта и с тех пор использую ее для всех своих экспериментов с иммунофлуоресценцией. Рекомендую попробовать, если вы никогда не пользовались ими раньше!