Бактерии способны прикрепляться к большинству поверхностей и со временем образуют сообщества, известные как биопленки, при благоприятных условиях.
Бактериальные биопленки присутствуют во многих важных явлениях нашей повседневной жизни, как полезных, так и вредных. От зубного налета до обрастаний на кораблях, хронических инфекций и экологически чистых удобрений. Исследования по биопленкам, имеющим множество потенциальных применений, продолжаются. Однако большую часть времени биопленки изучают в объемных культурах, в статических или ex situ условиях, что не отражает их динамическую природу.
В этой статье биопленки будут выращиваться в простом канале микрофлюидного чипа для наблюдения за их развитием на месте в условиях потока, чтобы улучшить экологическую значимость, а затем проверить их свойства.
Применение тестирования биопленки
- Толерантность к антибиотикам и резистентность
- Заселение поверхностей бактериями
- Эволюция бактериальных сообществ
- Взаимодействие видов микроорганизмов
- Образование биопленки
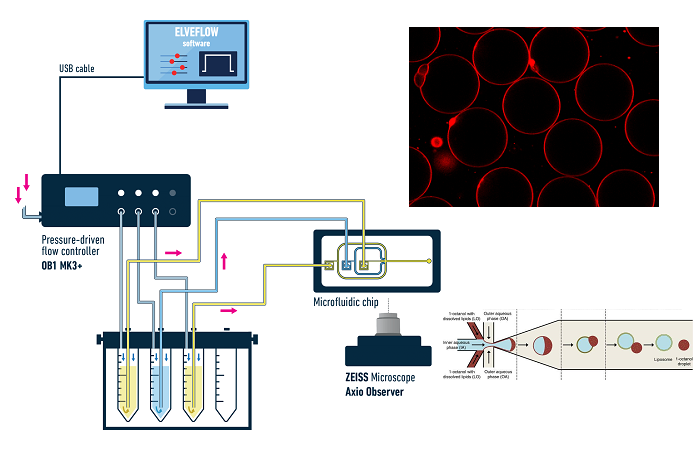
Экспериментальное оборудование
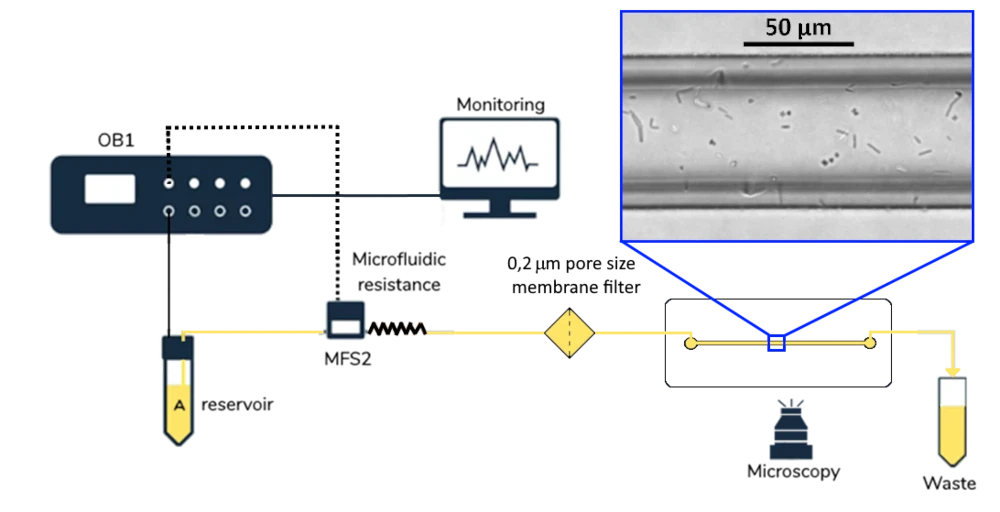
Рисунок 1 Схема установки
Аппаратное обеспечение
|
Химикаты
Программное обеспечение
|
Дизайн чипа
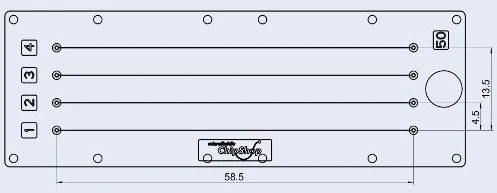
Предлагаемая микросхема состоит из четырех различных устройств с прямым каналом. В этом приложении использовался канал с сечением 50×50 мкм. Любая другая ширина и длина также могут работать, но скорость потока будет иметь другой профиль скорости, который может повлиять на формирование биопленки. TOPAS был выбран за его химическую стойкость к этиловому спирту, что позволяет использовать обычные дезинфицирующие средства в случае протечек или любого загрязнения поверхности без ущерба для целостности чипа.
|
Параметры |
Значения |
|
Способ подключения |
Mini Luer |
|
Ширина канала |
50 мкм |
|
Высота канал |
50 мкм |
|
Материал |
TOPAS (COC) |
|
Поверхностная обработка |
Нет |
|
Толщина крышки |
140 мкм |
Инструкция по началу работы
Подключение прибора
- Подключите контроллер давления OB1 к внешнему источнику давления с помощью пневматической трубки и к компьютеру с помощью кабеля USB.
- Подсоедините датчик потока к OB1.
- Включите OB1, нажав кнопку питания.
- Запустите программу Elveflow.
- Нажмите Add instrument \ выберите OB1 \ установите, как MK4, при необходимости установите каналы давления (если необходимо), дайте имя прибору и нажмите OK, чтобы сохранить изменения. Теперь ваш OB1 должен быть в списке распознанных устройств.
- Калибровка OB1 требуется при первом использовании.
- Добавьте датчик расхода: нажмите Add sensor\выберите датчик расхода\аналоговый или цифровой (выберите рабочий диапазон скорости потока для датчика, если у вас аналоговый), дайте имя датчику, выберите к какому устройству и каналу датчик подключен, и нажмите OK, чтобы сохранить изменения. Ваш датчик потока должен быть в списке распознанных устройств.
- Откройте окно OB1.
- В окне OB1 в каждом из рабочих каналов откройте настройки, связанные с датчиком, и в значениях PID измените как чувствительность, так и плавность с 0,001 на 0,008.
Советы от эксперта. Эти параметры адаптированы к воде, если используются жидкости с разными свойствами и вязкостью, эти значения нуждаются в регулировке для надежного регулирования потока.
Приготовление раствора
- Для бактериальной суспензии: Под ламинарным вытяжным шкафом заполните резервуар стерильной средой LB и инокулируйте ночной культурой при 37 ° C (оптическая плотность> 1) и регулируйте до тех пор, пока оптическая плотность не достигнет 0,1.
- Для питательной среды: под ламинарным колпаком налейте свежую среду LB в резервуар и добавьте любые реагенты для тестирования. В этом случае добавляли 1% (масса/объем) глицерина и 0,1 мМ MnCl2.
- Закройте резервуар черной напорной крышкой, в которую уже вставлена стерильная трубка с внешним диаметром 1/32 дюйма. Закройте входное отверстие для сжатого воздуха лентой во избежание загрязнения, пока оно не будет подключено к OB1.
Подготовка к настройке
- Соедините крышку резервуара с OB1 пневматической трубкой.
- Подсоедините резервуар к MFS2 с помощью трубки 1/32 дюйма. Добавьте сопротивление длиной 20 см и 100 мкм внутреннего диаметра к микрофлюидной трубке и к выходу датчика потока.
- Подсоедините конец сопротивления к трубке 1/32 дюйма, используя соединитель.
Советы от эксперта. Для получения более подробной информации об использовании сопротивления для получения наилучших характеристик с точки зрения управления скоростью потока.
- Откройте индивидуально упакованный стерильный фильтр для шприца. Подсоедините трубку 1/32” к фитингу Люэра с наружной резьбой, затем добавьте мембранный фильтр шприца, а затем добавьте фитинг Люэра с внутренней резьбой и трубку 1/32”.
Советы от эксперта. Бактерии имеют тенденцию образовывать биопленку внутри всех трубок, к которым у них есть доступ, что может повлиять на работу MFS2 и со временем засорить трубки сопротивления. Чтобы защитить микрофлюидный контур, в линию можно добавить стерильный шприцевой фильтр, чтобы предотвратить попадание бактерий на какой-либо компонент, расположенный выше по потоку, и в резервуар со стерильной средой.
- Подсоедините свободный конец трубки 1/32 дюйма к мини-фитингу Люэра.
- Под ламинарным колпаком извлеките чип из упаковки и инокулируйте его бактериальной суспензией. Используйте пипетку, чтобы полностью заполнить чип от одного конца до другого и закрыть входные отверстия парафильмом, чтобы предотвратить загрязнение.
- Подключить чип (поскольку чип прямоканальный, вход и выход взаимозаменяемы).
- Подсоедините трубку 1/32 дюйма к выходному отверстию чипа с помощью мини-фитинга Люэра и закрепите другой конец в безопасном контейнере для отходов.
Советы от эксперта. Отходы, зараженные бактериями, представляют биологическую опасность. Таким образом, они должны содержаться в соответствии с уровнем безопасности красителя, используемого для обеспечения безопасности.
Эксперименты
- Оставьте микрожидкостный чип не менее чем на 30 минут, чтобы бактерии могли прикрепиться к стенкам. Это время может варьироваться в зависимости от штамма.
Советы от эксперта. После инкубации воздух сначала будет проталкиваться через чип, вытесняя всю бактериальную взвесь. Большинство прикрепленных клеток останутся прикрепленными после проталкивания воздуха с предложенной скоростью потока. Также можно сначала выпустить воздух из трубки при отсоединенном чипе, а затем снова подключить чип с помощью жидкости, текущей медленно.
- Поместите чип на предметный столик микроскопа. В окне управления OB1 выберите соответствующий канал к резервуару и пропустите среду со скоростью 5 мкл/мин, пока фильтр почти не заполнится раствором.
- Установите значение скорости потока на 1 мкл/мин и подождите, пока раствор не достигнет резервуара для отходов.
- Оставьте установку включенной на необходимое время. В этом случае значительный рост биопленки был достигнут через 9 часов. В одном и том же канале в одном эксперименте может образовываться множество биопленок, считая повторы для одних и тех же условий.
Результаты микрофлюидного тестирования биопленки
Промежуток времени формирования и развития биопленки под потоком был получен путем фотографирования одной и той же биопленки в разные моменты времени (рис. 1). В проведенном эксперименте внутри микрофлюидного канала сформировались три биопленки, размеры которых были количественно определены с течением времени (рис. 2). При желании резервуар с питательной средой можно заменить после развития биопленки для проверки действия различных веществ, например, антибиотиков. Точно так же можно использовать красители для окрашивания бактерий и получения флуоресцентных изображений.
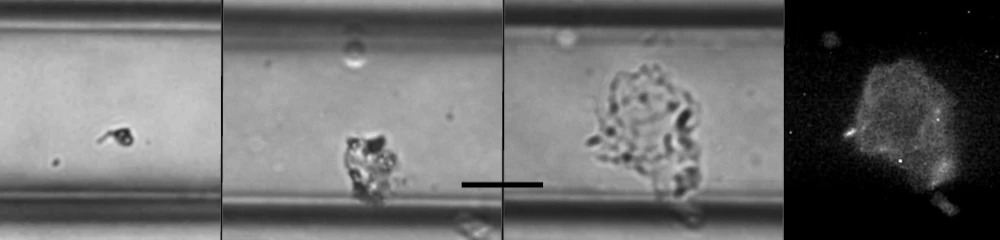
Рисунок 2. Рост биопленки в микрожидкостном канале. А-С. Интервальные изображения той же биопленки в светлом поле через 1, 5 и 9 часов. D. Флуоресцентное микроскопическое изображение биопленки через 9 часов. Масштаб представляет собой 25 мкм.
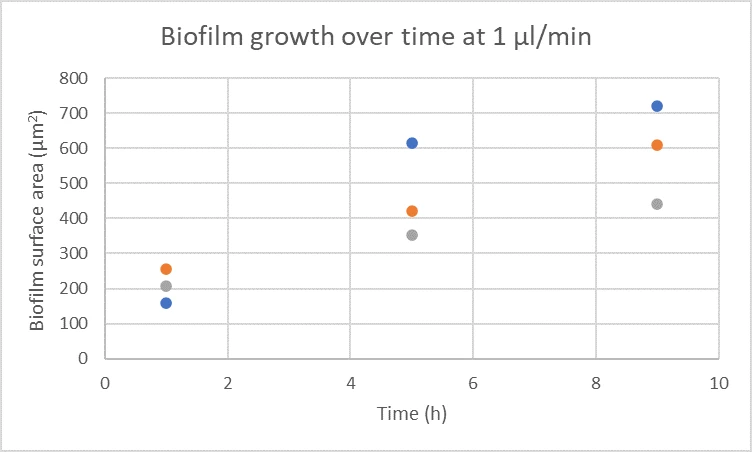
Рисунок 3. Количественная оценка роста биопленки с течением времени. Измеряли площадь поверхности трех отдельных биопленок (синие, оранжевые, серые точки) в течение 9 часов роста в потоке в микрожидкостном канале.