Авторы:
Carsten Forthmann, Jürgen J. Schmied (GATTAquant GmbH, Braunschweig, Germany), Tamara Straube (Leica Microsystems)
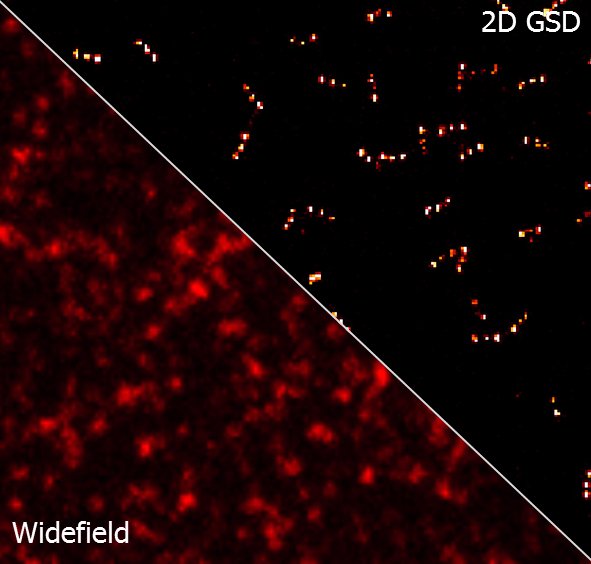
Флуоресцентные маркеры-нанолинейки на основе структур ДНК-оригами, производимые компанией GATTAquant, представляют собой идеальные тестовые образцы, которые в течение нескольких минут сообщают Вам о состоянии Вашего микроскопа и помогают качественно тестировать настройки и конфигурацию Вашего микроскопа со сверхвысоким разрешением. В данной статье маркеры-нанолинейки использовались для тестирования производительности микроскопа Leica SR GSD 3D. Были использованы как двумерные, так и трехмерные структуры, изображения которых были получены со сверхвысоким разрешением с помощью техники микроскопии супер-разрешения на основе локализации DNA-PAINT. Результаты показывают, что эти наноразмерные структуры являются оптимальными тестовыми образцами для количественного определения разрешения.
Вступление
Одной из основных проблем световой микроскопии всегда было ограниченное оптическое разрешение, вызванное дифракционными эффектами, которые были описаны Эрнстом Аббе в 1873 году [1]. Это приводит к проблеме, заключающейся в том, что микроскопические изображения с большим увеличением выглядят размытыми и скрывают информацию о структурных деталях в исследуемом образце. В последние годы появилось несколько методов микроскопии, которые преодолевают дифракционный предел Аббе, давая возможность получать микроскопические изображения с гораздо более высоким разрешением. Эти так называемые методы микроскопии сверхвысокого разрешения используют физический (например, STED [2] или SIM [3]) или химический подход (например, GSDIM [4] или DNA-PAINT [5]) для увеличения оптического разрешения. Этот прорыв в области микроскопии сверхвысокого разрешения был удостоен Нобелевской премии по химии в 2014 году. Однако в течение длительного времени у этих методов была проблема, заключающаяся в том, что не было стандартизированного способа количественного определения достигнутого разрешения определенного микроскопа сверхвысокого разрешения. Кроме того, часто неясно, какой из методов сверхвысокого разрешения является наиболее подходящим для ответа на конкретный биологический вопрос. До настоящего времени наиболее распространенным способом демонстрации эффективности техники сверхвысокого разрешения являлась визуализация цитоскелета [6]. Таким образом, структуры из эукариотических цитоскелетов, таких как микротрубочки или актиновые нити, могут быть визуализированы как ограниченные дифракцией изображения, а также изображения со сверхвысоким разрешением. Затем оба изображения показываются вместе (рис. 1 а, b), подчеркивая улучшение разрешения, хотя и качественным способом. Для количественного определения пространственного разрешения обычно выбирают две нити, которые расположены параллельно и близко друг к другу и являются узко разрешаемыми (рис. 1b), и проводят измерение расстояния между ними. Самое короткое расстояние, найденное таким образом, называется достигнутым пространственным разрешением (рисунок 1d).
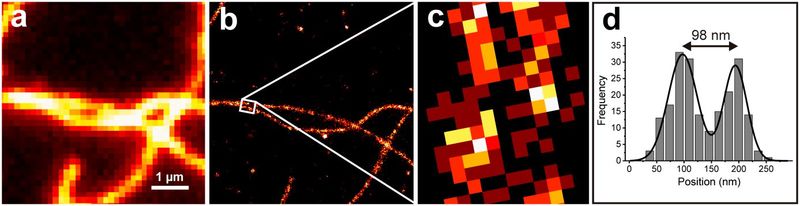
Рис. 1: Демонстрация типового разрешения с использованием клеточных структур: изображение TIRF (a) и изображение сверхвысокого разрешения (b) иммобилизованных нитей актина и выделенной области увеличения (c) с соответствующей гистограммой сечения (d).
Это, конечно, кажется очень произвольным методом определения оптического разрешения, поскольку нет никакого контроля за распределением изображенных нитей и особенно расстояний между ними. Кроме того, из-за того, что каждое расстояние между нитями уникально, статистический анализ невозможен. Стремление во всех отношениях разработать лучшие стандарты разрешения привело к разработке стандартов определения сверхвысокого разрешения на основе структур ДНК-оригами [7].
Метод ДНК-оригами
Основной технологией для построения этих определенных структур на наноразмерном уровне, изобретенной в 2006 году Полом Ротемундом, является так называемая техника «ДНК-оригами» [8]. Структура ДНК-оригами состоит из длинной (около 7000–8000 пар оснований) одноцепочечной молекулы ДНК, так называемой «цепочки каркаса» (рис. 2а). Путем добавления около 200 коротких одноцепочечных молекул ДНК (так называемых «штапельных нитей»), которые имеют комплементарные последовательности, к различным частям цепочки каркаса, соответствующие части каркаса могут быть соединены друг с другом (Рисунок 2b-d). Посредством этих определенных соединений каркас может быть сложен по желанию в любую структуру, посредством чего создание формы выполняется путем правильного выбора последовательностей сшивания нитей. Нагревая нити каркаса вместе с короткими штапельными нитями, буфером и солями и медленно охлаждая их до комнатной температуры, происходит процесс складывания, и структура ДНК-оригами складывается в собранную конструкцию.
Типичные структуры ДНК-оригами имеют размеры от 50 до 300 нм и могут иметь форму плоских прямоугольников, стержней, кубиков, но, по существу, любой формы, как показано на рисунке 3.
Известно, что положение каждой короткой основной нити в структуре ДНК-оригами дает возможность расположения молекул органических красителей с нанометровой точностью на структурах ДНК-оригами. Следовательно, соответствующую штапельную цепь необходимо пометить молекулой органического красителя, которая затем включается в структуру ДНК-оригами в процессе складывания (рис. 2, d). Поскольку каждая из около 200 основных нитей может быть помечена по желанию индивидуально, структуры ДНК-оригами можно рассматривать как молекулярный макет, который позволяет позиционировать молекулы органических красителей и практически каждый объект, который может быть прикреплен к одноцепочечной ДНК с точностью до нанометра (рис. 2f). Это позволяет создавать флуоресцентные метки на структурах ДНК-оригами с определенными расстояниями между ними, а также с определенным количеством молекул красителя, что является идеальной структурой для проверки достижимого пространственного разрешения флуоресцентных микроскопов и особенно микроскопов со сверхвысоким разрешением.
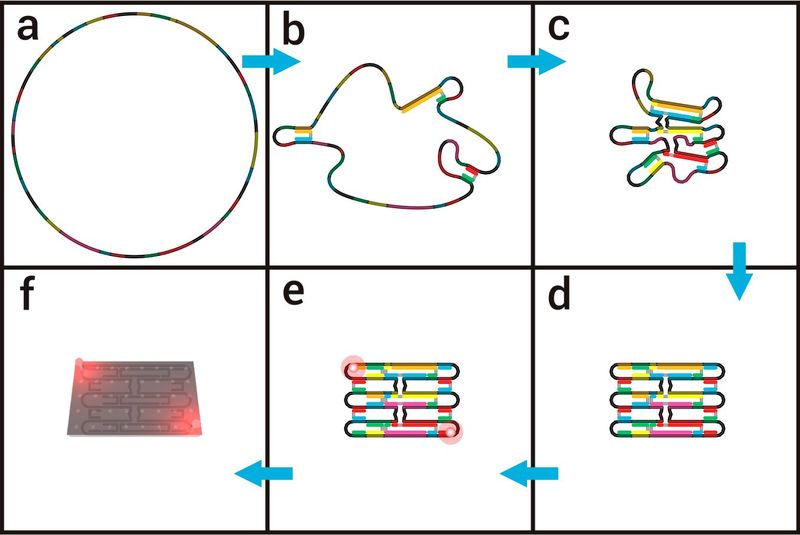
Рис. 2: Схематическое изображение конструкции ДНК-оригами и ее использование в качестве наноскопической линейки: (a-d): Сворачивание структуры ДНК-оригами путем добавления основных нитей к каркасу. (е): Добавление молекул красителя с использованием меченых штапельных нитей. (f): Основное использование структуры ДНК-оригами в качестве молекулярного макета.
Из-за высокой параллельности метода ДНК-оригами каждое изображение содержит не только одну нанолинейку, но и миллионы идентичных нанолинеек, что обеспечивает возможность измерения достижимого пространственного разрешения микроскопов сверхвысокого разрешения и вычисление статистических ошибок этого измерения [6]. Буфер изображения, а также плотность молекул красителя можно регулировать в соответствии с условиями, которые можно найти в реальных образцах, представляющих интерес.
Компания GATTAquant - молодая начинающая компания, которая занимается разработкой и изготовлением нанолинеек на основе ДНК-оригами для любого типа микроскопии сверхвысокого разрешения. Являясь дочерним предприятием группы профессора Филиппа Тиннефельда из Университета Брауншвейга, компания обладает огромным опытом в области нанотехнологий ДНК, в области фотофизики и визуализации в сверхвысоком разрешении.

Рис. 3: Схематичное изображение нескольких нанолинеек компании GATTAquant
Этот экспертный опыт привел к разработке многих высококачественных наноразмерных продуктов для различных методов микроскопии сверхвысокого разрешения таких как STED, SIM, GSDIM (dSTORM) и DNA-PAINT, а также для традиционной конфокальной микроскопии ограниченной дифракцией (рис. 3) [7].
Микроскопия сверхвысокого разрешения с ДНК-краской
Подход, основанный на микроскопии локализации, особенно метод ДНК-краски (DNA-PAINT), будет объяснен ниже более подробно. Микроскопия на основе локализации использует тот факт, что центроид одной молекулы красителя, хотя его сигнал на детекторе является размытым пятном, может быть рассчитан с высокой точностью и со стандартным отклонением (которое зависит от количества фотонов), которое намного меньше, чем размер размытого пятна. В настоящее время типовая точность локализации (стандартное отклонение) молекул органических красителей находится в диапазоне 5–10 нм [9]. Однако для расчета центроидов молекул органических красителей необходимо убедиться, что в любой данный момент времени только одна молекула красителя излучает свет в области пятна, ограниченного дифракцией. Чтобы обеспечить это условие, эмиссия перекрывающихся молекул должна быть временно разделена путем возбуждения "мигающей" эмиссии. Затем мигающие молекулы могут быть впоследствии локализованы и, наконец, из всех этих локализаций может быть восстановлено изображение сверхвысокого разрешения. Основным отличием всех методов микроскопии сверхвысокого разрешения, основанных на локализации, является то, как они используются, чтобы заставить молекулы мигать. Большинство методов (таких как GSDIM, dSTORM или PALM) используют фотофизическое переключение молекул между флуоресцентным включенным и нефлуоресцентным выключенным состоянием, которое возбуждается фотонами света или химическими реакциями. Совершенно другой подход применяется методом ДНК-краски (DNA-PAINT). Здесь структура, подлежащая визуализации, помечена непосредственно не флуоресцентными молекулами, а одноцепочечными цепями ДНК, которые работают как места связывания для меченой красителем одноцепочечной ДНК, так называемыми нитями формирователя изображения. Длина нитей формирователя изображения достаточно коротка, чтобы связывать только временно, что приводит к множественным событиям связывания и развязывания на каждом месте связывания. Поскольку молекулы органического красителя нитей формирователя изображения видны только при связывании со структурами ДНК-оригами на поверхности и невидимы, когда они свободно диффундируют в растворе, такое место связывания имеет такую же излучающую характеристику, что и одна молекула мигающего красителя (рисунок 4) [5].
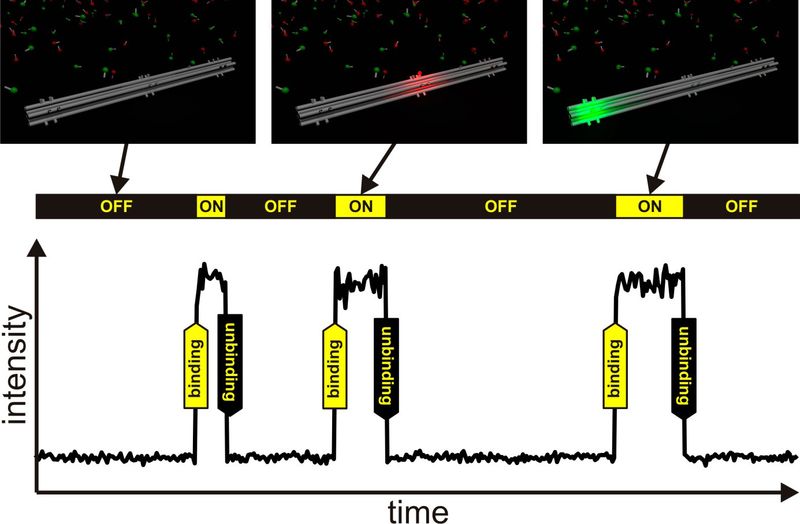
Рис. 4: Иллюстрация метода визуализации ДНК-краски. Временное связывание цепи формирования изображения со структурой ДНК-оригами
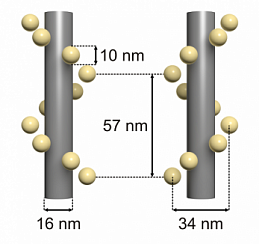
Тем не менее, есть несколько преимуществ по сравнению с одной мигающей молекулой красителя. Наиболее важным из них является тот факт, что образцы ДНК-краски не подвержены фотообесцвечиванию, поскольку молекулы органических красителей обмениваются каждый раз, когда новая нить формирователя изображения связывается со структурой ДНК-оригами. Кроме того, методика требует только одного источника возбуждения, и мультиплексирование является простым процессом. Основанная на методе ДНК-краски серия тестовых маркеров GATTA-PAINT предлагает нанолинейки, содержащие три метки с расстояниями от метки до метки 20 нм, 40 нм или 80 нм. Чтобы протестировать достижимое пространственное разрешение микроскопов на основе методов локализации в сверхвысоком разрешении на основе 3D локализации, компания GATTAquant в настоящее время разрабатывает нанолинейки, которые обеспечивают расстояния между маркерами также в осевом направлении. Одна многообещающая структура ДНК-оригами имеет форму тетраэдра с осевым расстоянием 80 нм.
Коррекция дрейфа в методе ДНК-краски
Общей проблемой, особенно в микроскопии сверхвысокого разрешения на основе локализации, когда время записи изображения может легко превысить несколько минут, является проблема бокового и осевого дрейфа образца, вызванная механической и/или тепловой нестабильностью, приводящей к размытому изображению, которое не содержит любые разрешимые структуры.
Дрейфа можно избежать во время получения изображения с помощью стабильной платформы формирования изображений или с помощью автофокуса. Поправка на боковой дрейф может быть выполнена после получения изображения путем постобработки полученных данных. Поэтому к образцу добавляются так называемые фидуциальные маркеры, которые служат ориентирами. Контрольные точки локализуются в каждом кадре во время получения изображения, что приводит к временному следу X- и Y-координат каждого контрольного маркера. Отдельные следы всех выбранных фидуциальных маркеров затем объединяются в один временный след для координат X и Y.
Для обоих рассчитывается компенсационная кривая, которая обычно выполняется с помощью подбора полинома или некоторого скользящего среднего алгоритма. Эта компенсационная кривая затем вычитается из всех координат в изображении со сверхвысоким разрешением. Обычные фидуциальные маркеры представляют собой флуоресцентные шарики, то есть наноразмерные сферы, заполненные молекулами красителя. Однако они демонстрируют пару недостатков: сигнал флуоресценции обычно слишком яркий, то есть он насыщает детектор, динамический диапазон которого оптимизирован для обнаружения одной молекулы. Сигнал шарика не является постоянным во времени и снижается из-за эффектов фотообесцвечивания, и шарики обычно не идеально прилипают к поверхности, то есть их положения не стабильны во времени.
Эти недостатки можно преодолеть с помощью DNA-PAINT-фидуциальных маркеров на основе структуры ДНК-оригами (далее именуемых PAINT-FM). Маркеры PAINT-FM представляют собой структуры ДНК-оригами, которые несут множество мест связывания ДНК-краски, гарантирующих, что в условиях ДНК-краски в любой данный момент пара молекул красителя будет расположена на маркере PAINT-FM. Это дает не отбеливающий флуоресцентный сигнал, исходящий от маркера PAINT-FM, который достаточно яркий, чтобы обеспечить достаточно точную локализацию маркера PAINT-FM, но не слишком яркий для детектора. Кроме того, маркеры PAINT-FM могут быть стабильно связаны с поверхностью посредством связки биотин-нейтравидин-биотин, то есть они сохраняют стабильное положение во времени. Эти преимущества по сравнению с обычными шариками делают маркеры PAINT-FM в сочетании с нанолинейками GATTA-PAINT идеальным тестовым образцом для микроскопии сверхвысокого разрешения на основе локализации.
Измерение разрешения с помощью микроскопа Leica SR GSD 3D
Чтобы выполнить измерение сверхвысокого разрешения по методу GSD, предметное стекло, содержащее готовые к использованию маркеры-нанолинейки GATTA-PAINT (рис. 5а), должно быть закреплено во вставке образца. Дальнейшая пробоподготовка не требуется. После настройки камеры и параметров изображения и определения глубины проникновения с помощью программного обеспечения изображение со сверхвысоким разрешением напрямую восстанавливается во время получения изображения. Сигналы одиночного излучателя устанавливаются с помощью алгоритма Гаусса или центра масс.
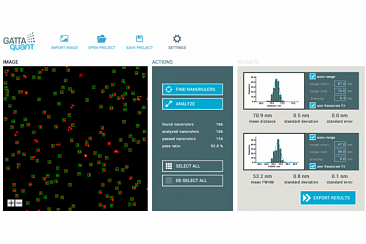
После завершения измерения данные отображались в многоцветном изображении (рис. 5b) и анализировались с помощью программного инструмента GATTAnalysis компании GATTAquant. Поэтому данные локализации, сохраненные в виде файла электронной таблицы, были импортированы в программное обеспечение GATTAnalysis, гарантируя, что различные столбцы файла данных были правильно связаны с соответствующими наборами данных. После импорта данные отображались в виде изображения в основном пользовательском интерфейсе. На втором этапе в изображении были обнаружены наноразмерные структуры. Это можно сделать полностью автоматически с помощью точечного источника или вручную, щелкнув соответствующие структуры. Затем выбранные структуры были проанализированы относительно расстояния от метки до метки и FWHM (полная ширина на половине максимума) каждой метки. Статистическим анализом этих значений результат сравнивался с расчетным значением расстояния (рис. 5c, d). Это сравнение, проведенное для измерений нанолинеек GATTA-PAINT 40RG, показало, что микроскоп Leica GSD легко способен различать образцы в поперечном направлении с расчетным расстоянием 40 нм в красном и зеленом каналах.
Если расстояния намного меньше, чем эти 40 нм, обычно боковой дрейф становится значительной проблемой. Поэтому были добавлены маркеры PAINT-FM к образцу с нанолинейками GATTA-PAINT 20R. Затем этот комбинированный образец также измеряли на микроскопе Leica SR GSD и после измерения подвергали последующей обработке для корректировки бокового смещения (рис. 5e-g). Это измерение доказало, что разрешение на расстоянии 20 нм было таким же, как и на большем расстоянии. Однако нескорректированные данные указывают на то, что в этом случае необходима достаточная коррекция дрейфа.
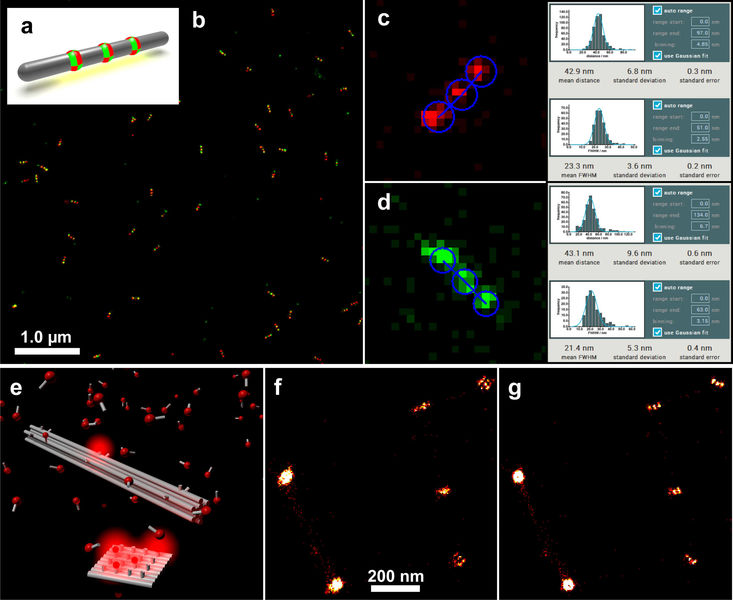
Рис. 5: (a): Схема нанолинейки GATTA-PAINT 40RG (красно-зеленая двухцветная тройная метка с расстоянием 40 нм). (b): GSD-изображение нанолинеек GATTA-PAINT 40RG. (c): Оценка красного канала с использованием программного обеспечения GATTAnalysis. (d): Оценка зеленого канала с использованием программного обеспечения GATTAnalysis. (e): Схематическая иллюстрация нанолинейки DNA-PAINT, изображенной вместе с маркером PAINT-FM. (f-g): Нескорректированное (f) и дрейф-корректированное (g) изображение сверхвысокого разрешения образца, содержащего нанолинейки GATTA‑PAINT 20 нм и маркер PAINT-FM.
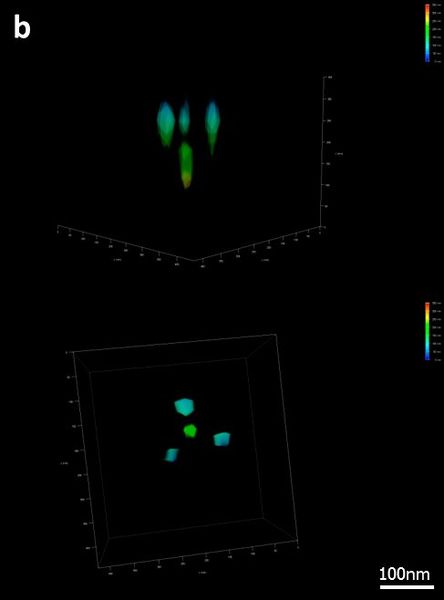
Кроме того, на микроскопе Leica SR GSD была также измерена трехмерная структура на основе ДНК-оригами. Структура представляла собой тетраэдр с длиной ребра 100 нм и флуоресцентной меткой (место связывания ДНК-краски) на каждой вершине [10]. Осевое расстояние составляло 80 нм. Эта структура также была легко различима с помощью микроскопа Leica SR GSD 3D (Рис. 6b).
Для получения 3D изображения с высоким разрешением цилиндрическая линза вставляется в путь эмиссионного пучка, создавая астигматизм. Для каждой отдельной Z-позиции измеряется форма сигнального пятна, что в итоге приводит к корреляции между формой пятна и Z-позицией. Эта корреляция затем может быть использована для осевой локализации молекул красителя (рис. 6а).
Для количественных измерений расстояния полученные значения Z должны были быть скорректированы из-за эффекта, вызванного показателем преломления. Это связано со следующей особенностью: прежде чем измерить абсолютные значения для Z-координаты излучателя, микроскоп необходимо откалибровать. Это делается путем регистрации флуоресцентного шарика в 3D. Полученные значения формы PSF как функции от осевого положения затем используются для вычисления координат молекул образца. Однако, поскольку флуоресцентный шарик, используемый для калибровки, непосредственно прикреплен к поверхности, путь прохождения света через раствор отсутствует, как при окончательном измерении сверхвысокого разрешения. Это приводит к несоответствию дифракционного индекса между калибровкой и измерением. Чтобы преодолеть этот эффект, все значения Z должны быть скорректированы с помощью определенного поправочного коэффициента, который может быть определен согласно Schmied, Forthmann et al. [11]. Для этого измерения поправочный коэффициент был определен до значения 0.42. После коррекции измеренное расстояние от метки до метки маркера соответствовало теоретическому значению тетраэдра.
|
(a) |
(b) |
Рис. 6: (a) Принцип трехмерного GSD: Для обеспечения возможности локализации молекул в направлении Z цилиндрическая линза внедрена в путь луча излучения микроскопа Leica SR 3D GSD, внося характерный астигматизм в функцию PSF. Величина искажения позволяет определить точное положение в измерении Z. (b) 3D GSD изображение 3D образца GATTA-PAINT 3В. Тетраэдр с четырьмя точками на расстоянии 80 нм и помечен флуорофором Atto655. Цветовое кодирование глубины показывает положение в измерении Z.
Выводы
После преодоления оптического дифракционного барьера Аббэ с помощью передовых методов микроскопии, таких как STED, GSDIM / dSTORM или DNA-PAINT, одной из основных проблем визуализации со сверхвысоким разрешением стало отсутствие стандартизированного способа количественной оценки достижимого пространственного разрешения. Это было решено исследователями из университета Брауншвейга путем разработки тестовых маркеров-нанолинеек на основе ДНК-оригами, которые в настоящее время коммерциализируются компанией GATTAquant. В статье было продемонстрировано, что эти нанолинейки в микроскопе Leica SR GSD 3D, показав, что эти наноразмерные структуры являются идеальными стандартами разрешения, которые подтверждают, что микроскопы Leica являются очень хорошо работающей системой формирования изображения с боковым разрешением лучше 40 нм и осевым разрешением лучше 80 нм.
Используемая литература:
1. Abbe E: Beiträge zur Theorie des Mikroskops und der mikroskopischen Wahrnehmung. Archiv für Mikroskopische Anatomie 9 (1): 413–68 (1873).
2. Klar T, Jakobs S, Dyba M, Egner A, und Hell SW: Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proc. Natl. Acad. Sci. USA 97 (15): 8206–10 (2000).
3. Gustafsson M, Shao L, Carlton P, Wang C, Golubovskaya I, Cande W, Agard D, and Sedat S: Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12): 4957–70 (2008).
4. Fölling J, Bossi M, Bock H, Medda R, Wurm C, Hein B, Jakobs S, Eggeling C, und Hell SW: Fluorescence nanoscopy by ground-state depletion and single molecule return. Nat. Methods 5: 943–45 (2008).
5. Jungmann R, Steinhauer C, Scheible M, Kunzyk A, Tinnefeld P, and Simmel F: Single-Molecule Kinetics and Super-Resolution Microscopy by Fluorescence Imaging of Transient Binding on DNA Origami. Nano Letters 10 (11): 4756–61 (2010).
6. Schmied JJ, Raab M, Forthmann C, Pibiri E, Wünsch B, Dammeyer T, and Tinnefeld P: DNA origami–based standards for quantitative fluorescence microscopy. Nat. Protoc. 9: 1367 (2014).
7. Schmied JJ, Gietl A, Holzmeister P, Forthmann C, Steinhauer C, Dammeyer T, and Tinnefeld P: Fluorescence and super-resolution standards based on DNA origami. Nat. Methods 9: 1133–34 (2012).
8. Rothemund P: Folding DNA to create nanoscale shapes and patterns. Nature 440: 297–302 (2006).
9. Raab M, Schmied JJ, Jusuk I, Forthmann C, and Tinnefeld P: Fluorescence microscopy with 6 nm resolution on DNA origami. ChemPhysChem 15 (12): 2431–35 (2014).
10. Iinuma R., Ke Y, Jungmann R, Schlichthaerle T, Woehrstein JB, and Yin P: Polyhedra self-assembled from DNA tripods and characterized with 3D DNA-PAINT. Science 344: 65–69 (2014).
11. Forthmann C, Schmied JJ, Pibiri E, Lalkens B, Nickels P, Liedl T, and Tinnefeld P: DNA origami nanopillars as standards for three-dimensional superresolution microscopy. Nano Letters 13 (2): 781–85 (2013).