Кратко об оптогенетике
История концепции оптогенетики восходит к 1970-м годам, когда доктор Фрэнсис Крик, один из открывателей ДНК, описал словами, что в неврологии необходим метод управления нервными клетками одного типа, оставляя другие клетки не затронутыми, чтобы понять, как работает головной мозг.[1] Крик позже предположил, что свет будет таким средством управления нейронами извне, который позволит синхронизовать с произвольной временной точностью соответствующие сигналы обрабатываемые мозгом.
Независимо от исследований Фрэнсиса Крика биологами того времени были выявлены микроорганизмы, способные регулировать поток ионов (электрический заряд) через их мембраны с помощью светочувствительных белков (опсины). Основываясь на том, что активность нейронов регулируется потоком ионов через плазматическую мембрану, учёные в конце 1990-х годов начали исследовать применение светочувствительных белков для контроля нейронов, но исследователи не признавали опсины как пригодные для неврологии до 2000-х годов. Совместные усилия нескольких исследовательских групп принесли свои плоды только в 2005 году, когда впервые свет и однокомпонентный светочувствительный ионный канал были использованы для активации нейронов, что приводило к изменению поведения исследуемого животного.[2] Вскоре после этого были выявлены активируемые светом белки, которые могут подавлять активность нейронов, и в 2007 году впервые были использованы подавляющие опсины для демонстрации управления поведением исследуемого организма [3].
Начиная с 2005 года, когда было придумано само название «оптогенетика» и представлена технология, оптогенетика получила широкое применение и рассматривается как одна из самых больших революций в изучении головного мозга и его функций. Конечной границей нейронауки является понимание того, как головной мозг порождает наше поведение, и оптогенетика уже доказала свою беспрецедентную полезность. Активация и замедление опсинов были ориентированы на различные типы нейронов и области головного мозга у грызунов для выявления клеток и областей в центральном головном мозге, отвечающих за страх, тревогу, сон, голод, социальное поведение, обучение, память, агрессию, мотивацию и многое другое. Кроме того оптогенетика широко используется для понимания того, как изменения в активности головного мозга могут проявляться в расстройствах, таких как депрессия, шизофрения, аутизм, болезнь Паркинсона, эпилепсия и наркомания [4].
Поведение исследуемого организма представляет собой не только оптогенетические манипуляции, но также многое можно узнать о головном мозге путём объединения оптогенетики с другими технологиями, такими как электрофизиология или диагностические исследования с визуализацией. Опсины могут быть классифицированы по их эффективности (активация против замедления нервной активности), спектральной чувствительности (пик и интервал длин волн), средства переноса ионов через клеточную мембрану (канал или возбуждение), включение и выключение кинетики, свойства фототока и другое. Большинство опсинов могут быть активированы в широком интервале длин волн (рис. 1 и 2). На пике интервала генерируется максимальная активация и фототок. Доступные в настоящее время активируемые светом белки, использующиеся в оптогенетике, имеют длину волны и пик возбуждения в видимой или инфракрасной области спектра [5]. Наиболее часто для активации опсина используют каналродопсин 2 (Channelrhodopsin-2 (ChR2)), который имеет пик активации около 470 нм (синий свет), и опсины наиболее часто используемые для замедления нейронной активности - галорходопсины (halorhodopsins, NpHRs), которые оптимально активируются желтым светом (пик активации около 590 нм).
Важно отметить, что в последние годы была разработана обширная флора опсинов для оптогенетики. Когда появилась необходимость одновременной манипуляции поведением исследуемого организма, были разработаны опсины, например, чтобы проводить сменные активации и замедления популяции нейронов [6] или для параллельной активации двух различных популяций нейронов в пределах одной области головного мозга [7]. Оба варианта достигаются благодаря использованию света разных длин волн. Решающим значением в этих примерах является то, что с помощью различных длин волн света можно избирательно активировать один опсин, оставляя другие опсины неизменными. Если два опсина должны быть ориентированы на одну область головного мозга, спектральное перекрывание и относительные усиления генерируемых фототоков, должны быть приняты во внимание при выборе длин волн стимуляции и интенсивности излучения.
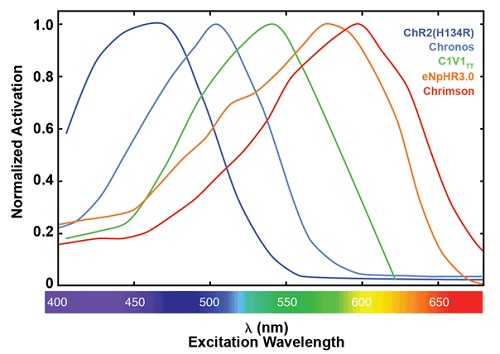
Рис. 1. Нормированные спектры активации для подбора опсинов. ChR2(H134R),10 Chronos,11 C1V1TT10 и Chrimson11 все активирующие опсины получены из каналродопсина-1 или каналродопсина-2, eNpHR3.012 - хлорид производный от галорходопсина.
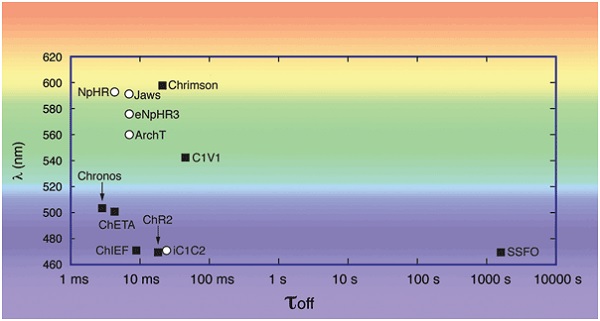
Рис. 2. Кинетика (τoff) и спектральных показателей (λ) для выбора опсинов. При планировании экспериментов оптогенетики, требующих активации двух отдельных популяций клеточных нейронов или одновременное включение и подавление одной нейронной популяции, длины волн активации сравниваются. Кинетика затухания опсина должна быть рассмотрена в экспериментах с использованием пульсирующего света на определённых частотах. Активация опсинов (белые круги): ChR2(H134R),5 C1V1TT (= C1V1 Cheta (E122T/E162T)), 5 Cheta (= ChR2(E123T)), 5 Chrimson, 11 Chronos,11 ChIEF510 и SSFO (= ChR2(C128S/D156A)). 5 замедляющих опсинов (черные квадраты): eNpHR3.0,5 NpHR, 5 Jaws, 12 ArchT1212 и iC1C2.9.
Последние достижения в оптогенетике включают в себя разработку опсинов, которые активируются при одной длине волны света и замедляются разными длинами волн – так называемые ступенчатые опсины [5]. Одиночный импульс света одной длины волны активизирует опсин и вызывает постепенное изменение ионных потоков в мембране нейрона, которые могут быть остановлены световым импульсом с другой длиной волны. Чаще всего синий свет используется для активации, а красный свет для замедления, но и другие комбинации длин волн также были использованы. Уже давно инженеры исследуют активацию опсинов чувствительных к красному свету [8].
Имплантация волокна в живые ткани требует сложной и высокоточной микрохирургии и часто создаёт определённую степень повреждения головного мозга. Синие и зелёные длины волн рассеиваются в головном мозге и поглощаются кровью, наконечник волокна должен быть размещён в непосредственной близости от нейронов для исследования эффективности активации опсинов, что затрудняет исследование с малыми и/или глубинными структурами головного мозга. Красный свет проникает в ткани головного мозга более эффективно, демонстрирует меньшее рассеяние и поглощение в крови и может даже активировать нейроны через неповреждённый череп [8]. Важным и недавним событием в оптогенетике стало создание ингибирующего канального родопсина, чувствительного к синему свету [9]. Этот новый способ позволяет быстрее и в большей степени замедлить оптическое восприятие нервной активности и демонстрирует повышенную чувствительность к свету.
Руководство по выбору подходящих источников света и волоконно-оптических компонентов для оптогенетических исследований с особым акцентом на поведение грызунов
Использование лазеров и оптики для оптогенетики находится только в зачаточном состоянии. В следующем десятилетии мы можем ожидать от исследователей раскрытия многих внутренних тайн человеческого мозга, а также, возможно, найти лекарства и методы лечения для некоторых из наших самых сложных психиатрических расстройств и заболеваний, помогая нам в достижении лучшего качества жизни. Оптогенетика строится на том, что свет активирует молекулы, называемые опсинами, которые могут находятся в нейронах (Рис.3). Светочувствительными нейронами можно управлять с помощью света с очень большой временной и пространственной точностью, соответствующей нормальной обработке информации головным мозгом. Разработка опсинов для оптогенетики – это бурно развивающаяся область и многие новые и значительно изменённые опсины неуклонно становятся доступными для удовлетворения потребностей научно-исследовательских применений, включая те, которые касаются исследования обезьян и человека.
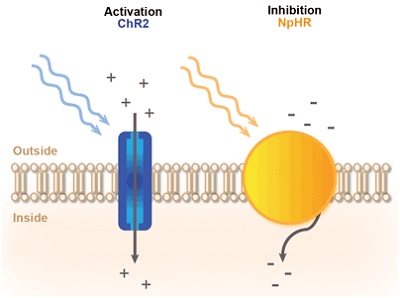
Рис. 3. Принцип светоопосредованного контроля нейронной активности. Обычно используется активация опсина-каналродопсина2 (ChR2), позволяющая вводить положительно заряженные ионы при освещении синим светом. В результате мембрана нейрона деполяризуется и генерируются потенциалы возбуждения. Замедляющий опсин - галорходопсин (NpHR) возбуждает отрицательно заряженные ионы при освещении жёлтым светом. В результате мембрана нейрона гиперполяризуется и потенциал возбуждения тормозится.
Стремительно развиваясь и имея междисциплинарный характер, оптогенетика представляет собой важную задачу. В частности трудной задачей для многих исследователей является определение точного набора источников света и волоконно-оптических компонентов для их конкретного применения в оптогенетике. Для удовлетворения потребностей в удобстве лазеров используемых для оптогенетики компания Cobolt (Швеция) работала совместно с лабораториями Мари Карлен и Константиноса Мелетиса в Каролинском институте в Стокгольме, чтобы разработать серию лазерных инструментов для выполнения этой задачи.
Оборудование для оптогенетики
В оптогенетике для манипулирования поведением живых организмов в качестве источников света применяются практически исключительно лазеры. Лазеры генерируют пучок почти параллельных лучей света с очень малой расходимостью, что позволяет эффективно фокусировать его на оптическое волокно – как правило, с диаметром сердцевины от 50 до 300 мкм. Многие эксперименты оптогенетики могут проводиться с использованием одного опсина и с односторонней оптической манипуляцией клетками, представляющими интерес (т.е. в одном полушарии головного мозга).
Были тщательно разработаны три различные конфигурации, которые соответствуют требованиям экспериментов оптогенетики: одномодовый лазер с волоконным манипулятором; два лазера на общей платформе, запускаемые в одно общее волокно манипулятора; или два лазера, находящиеся рядом и запускаемые каждый в своём манипуляторе, состыкованные со сплавленным волокном в комбинации два в одном. Лазеры в установках доступны с регулируемой мощностью 100 мВт на длинах волн 473 нм, 561 нм, 594 нм и 638 нм, где 561 нм и 594 нм - это твердотельные лазеры с диодной накачкой (DPSS) с модуляторами или обтюраторами.
К параметрам, которые необходимо учитывать относится диаметр сердцевины волокна и каким образом можно вставить волокно в головной мозг. На рис.4. представлена общедоступная предварительно вживляемая гильза с закреплённым коротким волокном. В ходе эксперимента длинные волокна вставлялись в рукав, который требуют идеальной поверхности контакта между коротким и длинным волокном. Кроме того катетер может быть имплантирован и непрерывные длинные волокна вводятся через катетер в головной мозг в ходе эксперимента. Конец волокна соединён с разъёмом, совместимым с разъёмом на манипуляторе лазерной установки (например, SMA или FC).

Рис. 4. Наконечник для имплантации оптического волокна в головной мозг
Более сложные эксперименты могут потребовать применения света двух отдельных длин волн, билатеральной (двухсторонней) стимуляции обоих полушарий и свободного передвижения животного. В настоящее время используются две основные методики для доставки двух разных длин волн. В первом случае два световых луча направлены и объединены в одно волокно манипулятора с помощью оптики. Одиночное волокно соединено с лазерной установкой, но если это необходимо можно разделить на два волокна. Второй метод позволяет избежать использования оптики, и каждый из двух световых лучей направлен в отдельное волокно манипулятора. Два волокна затем подключены к лазерной установке и если это необходимо, то они могут быть соединены в одно волокно. Для обеспечения свободного передвижения животного и исключения вращения волокна могут быть добавлены вращательные шарниры (рис. 5).

Рис. 5. Лазерная установка с подключённым оптическим волокном с разделёнными концами волокон и поворотным шарниром
Лазеры для оптогенетики
Основная задача нейробиологов – добиться достаточной освещённости в области головного мозга без подвергания живых тканей повреждениям. Как правило, в заданном месте для успешной манипуляции нейронной активностью требуется интенсивность излучения от 1 до 10 мВт/мм2, но опсины с повышенной светочувствительностью специально спроектированы для уменьшения необходимого количества света. Выбор лазерного источника для оптогенетики является довольно деликатным и на несколько параметров лазера нужно обратить особое внимание. Во-первых, после того, как был выбран соответствующий опсин необходимо выбрать лазер с выходной длиной волны, соответствующей чувствительности опсина. В настоящее время наиболее широко используются следующие длины волн 473 нм, 532 нм, 561 нм, 594 нм и 638 нм. Во-вторых, лазер должен обеспечивать достаточную выходную мощность для успешной активации опсина. Таким образом лазер должен иметь запас мощности для компенсации потерь при передаче сигнала по волокну. Также должна обеспечиваться регулировка мощности излучения, поскольку требования к свету для генерации фототока могут значительно отличаться у различных животных, например, из-за разной степени экспрессии опсина. Регулировка мощности лазера также необходима, чтобы избежать повреждения живых тканей из-за избыточной освещённости. Стандартное значение номинальной мощности составляет не менее 100 мВт, с полезной мощностью в диапазоне от 20 мВт и до номинального максимума. Третьим важным параметром является стабильность излучения во времени. Это очень важно, так как эксперимент может продолжаться в течение нескольких часов, а стабильность мощности гарантирует, что нежелательные структуры вызванные обработкой лазерным излучением не будут созданы из-за вариаций применяемого света. Следовательно, стабильность мощности лазера менее чем 2% является обязательным условием.
Также должна быть рассмотрена возможность лазерной модуляции. Частота модуляции зависит от физиологических процессов в оптогенетике, т.к. это определяется кинетическими свойствами опсина. Некоторые шаблоны активности в головном мозге длятся порядка секунд, в то время как другие достигают более 100 Гц. Также очень важно, чтобы времена нарастания и спада светового импульса были короткими, точными и в миллисекундном диапазоне. Не менее важно, чтобы форма импульса и уровень мощности от импульса к импульсу являлись последовательными и повторяющимися в течение всего эксперимента.
Два основных типа лазеров, используемых в оптогенетике - это DPSS лазеры и лазерные диоды. Оба типа энергоэффективны и имеют компактный дизайн, а также не требуют каких-либо систем охлаждения. Лазерные диоды наиболее экономически эффективное решение, доступное в синем и красном спектральном диапазоне, хотя ещё есть модели с излучением в зеленом, желтом или оранжевом спектре. Они могут быть напрямую модулированы с большой точностью и скоростью, ограниченной только электронной схемой драйвера (Рис. 6). Мощность лазерных диодов может быть изменена до непосредственной близости к нулю или до максимального номинального значения без разницы в стабильности.
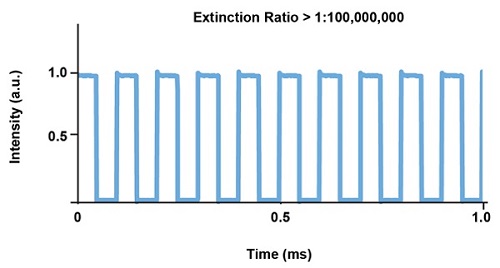
Рис. 6. Типовой график стабильности импульса для лазера Cobolt MLD на 473 нм с прямой модуляцией
Твердотельные лазеры с диодной накачкой (DPSS лазеры) представляют собой мощные высокопроизводительные источники излучения, используемые во многих сложных задачах. Они доступны с различным диапазоном длин во всём видимом спектре. Как правило, в оптогенетике используются DPSS лазеры с длинами волн 532 нм, 561 нм, 594 нм. Лазеры с оптической накачкой будут работать стабильно только в непрерывном режиме и при максимальной номинальной мощности, если детально не разработаны условия, чтобы они функционировали по-другому. Ограничение связано с конструкцией лазеров с оптической накачкой, таких как DPSS лазеры, так как диодный лазер накачивает кристалл лазера внутри оптического резонатора.
DPSS лазеры могут работать в широком динамическом диапазоне мощности, но имеют ограничения по возможности модуляции. Тем не менее модулированные DPSS лазеры, как правило, не имеют достаточно хорошей согласованности от импульса к импульсу и стабильности питания во время модуляции для удовлетворения требований задач оптогенетики. Поэтому для использования в оптогенетике DPSS лазерам нужен встроенный модулятор или быстрый затвор для модуляции света, что позволяет устройствам работать непрерывно и, следовательно, с как можно более высокой стабильностью (Рис. 7).
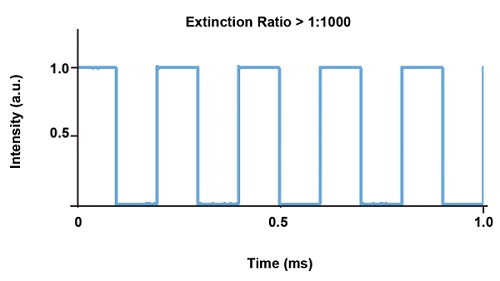
Рис. 7. Типовой график стабильности импульса для лазера Cobolt Mambo 594 нм со встроенным модулятором
Пример эксперимента
В приведенном ниже эксперименте зондируют нейроны, отвечающие за управление поведением живой мыши, чтобы избежать попадания в неприятные ситуации. Синий светочувствительный опсин ChR2 предназначен для активации нейронов в одном полушарии головного мозга у мыши, и одно оптическое волокно диаметром 200 мкм имплантируется в кончик волокна непосредственно прилегающего к нейронам для манипуляции поведением мыши. Прямоугольная коробка разделяется на две камеры стенкой с открытым проходом для исследования поведения. Программное обеспечение отслеживает движение мыши. Вход мыши в одну из камер запускает активацию синего лазера, который приводит к активации нейронов, представляющих интерес для исследования.
Рисунок 8 показывает, что применение света приводит к непосредственному выражению аверсивного поведения, т.е. мышь полностью избегает камеру, где активируется лазер. Для подтверждения факта, что аверсивное поведение вызвано именно активацией нейронов, а не внешними факторами лазер впоследствии срабатывает в другой камере. В результате, мышь теперь избегает этой камеры.
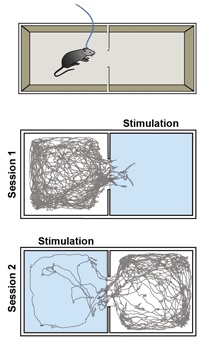
Рис. 8. Эта модель демонстрирует в режиме реального времени предпочитаемое место нахождения выбираемое мышью. Подряд в двух 10 минутных сериях с 20 секундным интервалом между сериями, лазерная стимуляция сначала срабатывает у входа мыши в правой камере, а затем в левой камере. Вторая серия начинается в то время, когда животное все ещё находится в левой камере, как можно видеть по трассировке ее перемещения. Лазер Cobolt MLD 473 нм с максимальной выходной мощностью 120 мВт был использован с разветвленным волокном. Микроконтроллер Arduino был запрограммирован на управление лазером, и программное обеспечение Biobserve отслеживало перемещение мыши. Частота стимуляции составляла 60 Гц с длительностью импульсов 2 мс.
Литература
1. F.H. Crick (1979). Thinking about the brain. Sci Am, Vol. 241, pp. 219-232.
2. G. Nagel et al (2005). Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol, pp. 2279-2284.
3. F. Zhang et al (2007). Multimodal fast optical interrogation of neural circuitry. Nature, Vol. 446, pp. 633-639.
4. K.M. Tye and K. Deisseroth (2012). Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat Rev Neurosci, Vol. 13, pp. 251-266.
5. O. Yizhar et al (2011). Optogenetics in neural systems. Neuron, Vol. 71, pp. 9-34.
6. F. Zhang et al (2007). Circuit-breakers: optical technologies for probing neural signals and systems. Nat Rev Neurosci, Vol. 8, pp. 577-581.
7. O. Yizhar et al (2011). Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature, Vol. 477, pp. 171-178.
8. J.Y. Lin et al (2013). ReaChR: a red-shifted variant of channelrhodopsin enables deep transcranial optogenetic excitation. Nat Neurosci, Vol. 16, pp. 1499-1508.
9. A. Berndt et al (2014). Structure-guided transformation of channelrhodopsin into a light-activated chloride channel. Science, Vol. 344, pp. 420-424.
10. J. Mattis et al (2012). Principles for applying optogenetic tools derived from direct comparative analysis of microbial opsins. Nat Methods, Vol. 9, pp. 159-172.
11. N.C. Klapoetke et al (2014). Independent optical excitation of distinct neural populations. Nat Methods, Vol. 11, pp. 338-346.
12. A.S. Chuong et al (2014). Noninvasive optical inhibition with a red-shifted microbial rhodopsin. Nat Neurosci, Vol. 17, pp. 1123-1129.






