Демонстрация токсичности классического обезболивающего ацетаминофена с использованием различных режимов взаимодействия
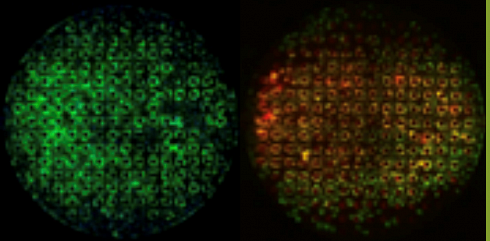
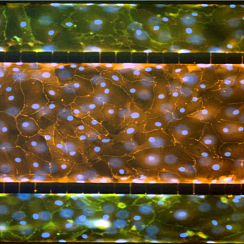
Гепатоциты культивировали в модели SynTox и анализировали на функциональность с помощью стандартных коммерчески доступных анализов. Гепатоциты формировали желчные каналикулы, производили мочевину в возрастающей концентрации в зависимости от времени с повышенной активностью ферментов в условиях физиологического потока жидкости.
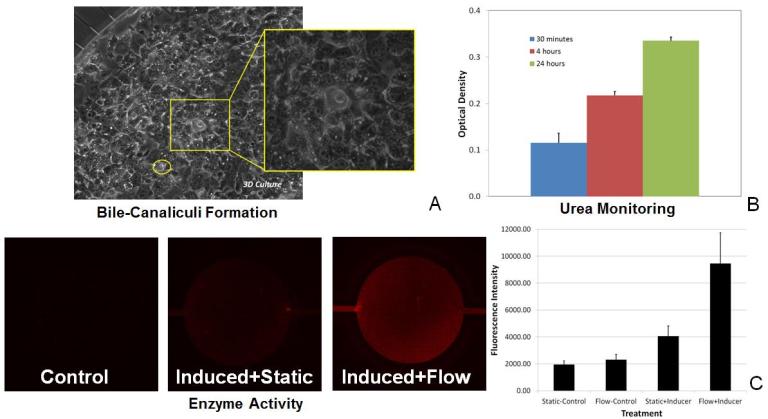
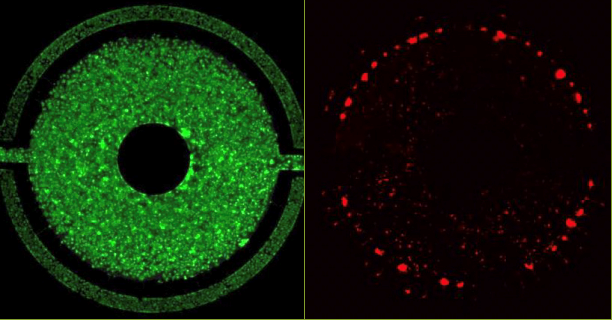
Гепатоциты образуют желчные каналикулы (Рисунок A), выделяют мочевину с повышенной продукцией в зависимости от времени (Рисунок B) и могут быть проконтролированы в режиме реального времени на предмет активности ферментов (Рисунок C). Влияние потока на гепатоциты четко прослеживается по увеличению активности ферментов.
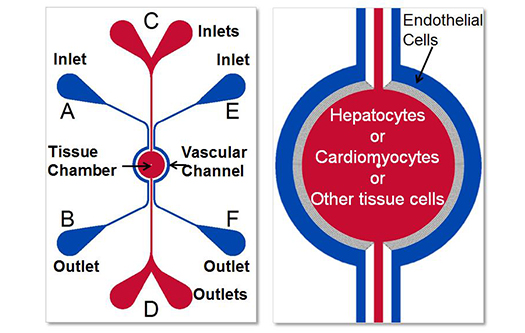
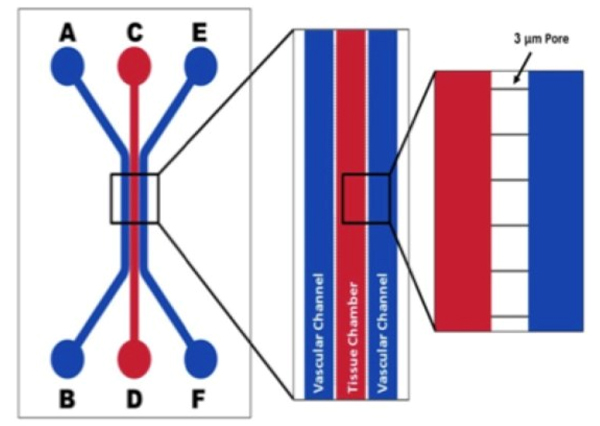
Токсикологическая модель SynTox была использована для понимания реакции токсичности лекарств с помощью анализа на основе системной биологии
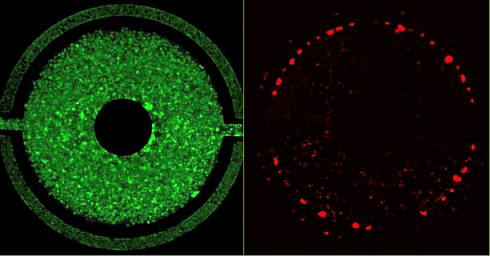
Клетки печени и клетки сердца совместно культивировались с соответствующими эндотелиальными клетками в микрофлюидном чипе SynTox и обрабатывались доксорубицином. Клетки были собраны и подвергнуты геномному анализу, в результате которого были выявлены повышенные и пониженные гены. Выявленные гены были использованы для разработки модели клеточных путей на основе системной биологии для идентификации мишеней и механизмов.
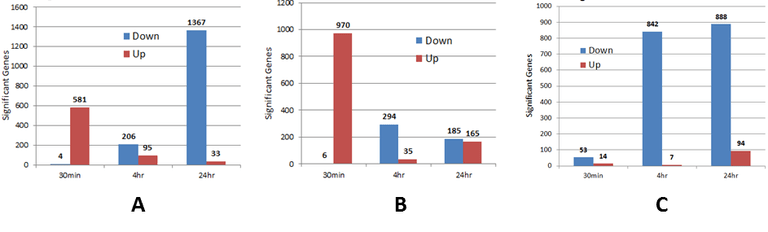
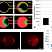
Геномные реакции, выделяющие клетки с повышенным и пониженным уровнем регуляции в эндотелиальных клетках (Рисунок A), гепатоцитах (Рисунок B) и сердечных клетках (Рисунок C).
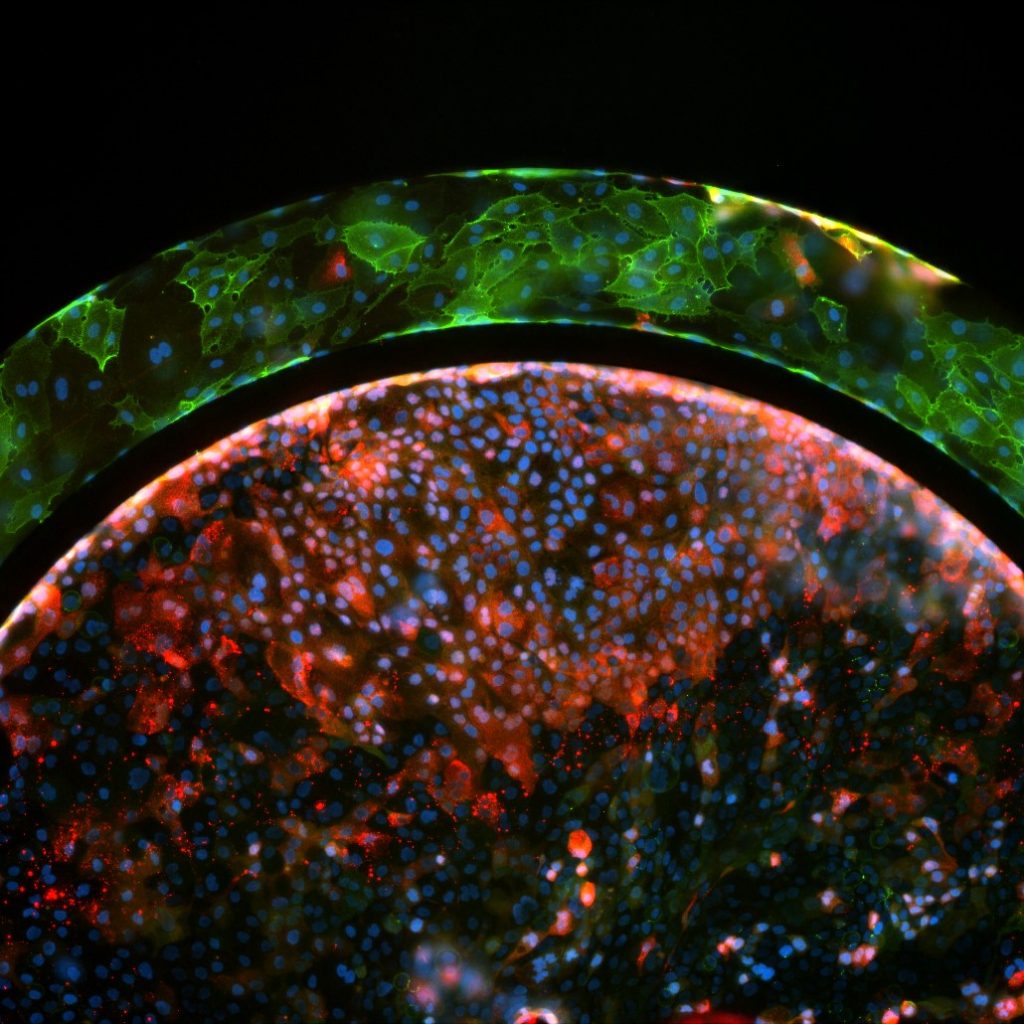
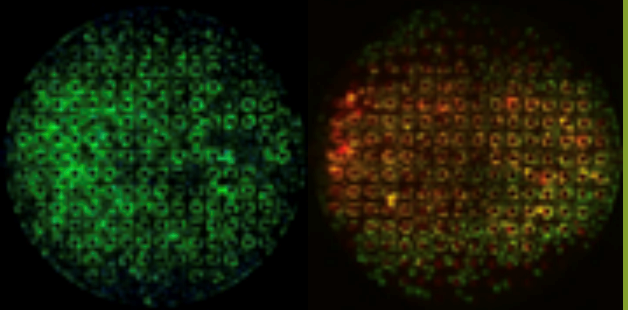
Монокультивированные гепатоциты или совместно культивированные с эндотелиальными клетками обрабатывались ацетаминофеном, и их реакция на лекарство исследовалась на предмет различных способов взаимодействия с использованием комбинации анализов на живые/мертвые клетки и реактивные виды кислорода (ROS). После взаимодействия лекарств наблюдались различия между сосудистой и прямой обработкой гепатоцитов.
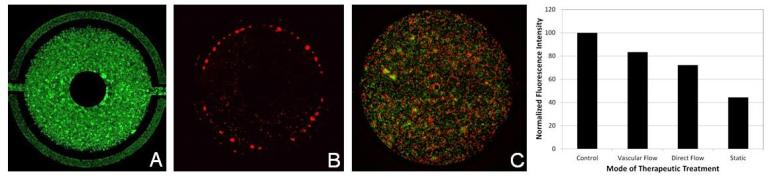
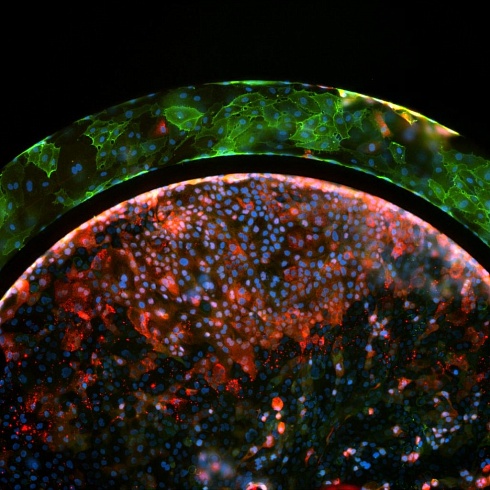
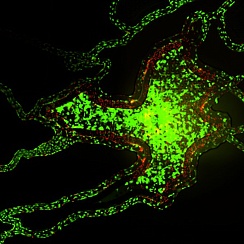
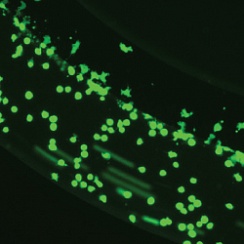
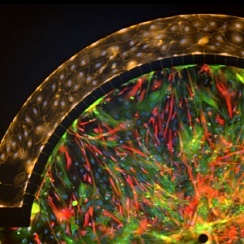
Жизнеспособные совместные культуры эндотелиальных клеток и гепатоцитов наблюдались в модели SynTox (Рисунок A). C. Совместно культивированные эндотелиальных клеток и клеток печени обрабатывали дозой ацетаминофена с последующим промыванием и непрерывной перфузией свежей среды. Как видно из изображений, клетки печени на периферии (рис. B) склонны к гибели по сравнению с клетками, расположенными вдали от сосудистой сети, поскольку они поглощают большую часть лекарств. В отличие от них, ни одна из эндотелиальных клеток не проявляет никаких признаков бедствия, что указывает на то, что они не подвержены воздействию препарата. Статическая обработка лекарством приводит к максимальной гибели клеток (Рисунок C). Сравнение различных режимов обработки лекарством при одинаковой дозировке и продолжительности (график). В отличие от статических систем, которые чрезмерно предсказывают токсические реакции, SynVivo воспроизводит терапевтические реакции in vivo.
Мониторинг диффузии лекарств и их токсичности в режиме реального времени
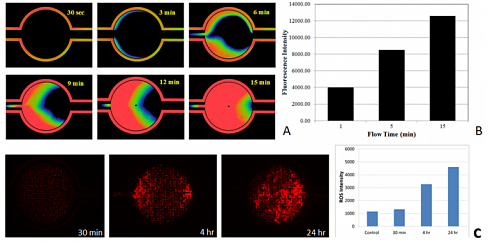
Микрофлюидный чип SynTox можно использовать для исследования диффузии лекарств в режиме реального времени через эндотелий сосудов и клетки тканей, чтобы определить продолжительность минимального или максимального воздействия на клетки. Полученная информация может быть использована для прогнозирования токсичности в зависимости от времени.
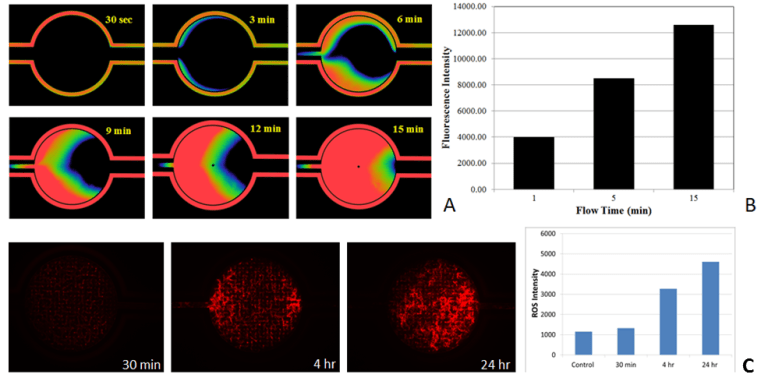
Мониторинг диффузии лекарств и токсичности в зависимости от времени в режиме реального времени. Диффузия лекарств через интерфейс эндотелий-ткань (Рисунок A). Зависимое от времени увеличение количества апоптотических клеток после химиотерапевтического лечения (рис. B). Зависимое от времени увеличение интенсивности ROS, указывающее на токсичность после химиотерапевтического лечения (рис. C).