С момента своего появления более 20 лет назад STED-микроскопия превратилась в мощный метод наблюдения за структурами клеток. Он обеспечивает сверхразрешение на уровне, который когда-то был сферой электронной микроскопии, и сочетает в себе многие преимущества традиционной флуоресцентной микроскопии, в том числе оптические срезы, специфичность белка и совместимость с живыми клетками. Кроме того, за последние несколько лет флуоресцентные маркеры стали намного более фотостабильными, импульсные лазеры резко снизили дозировку света, а работа инструментов STED значительно упростилась. Это, а также тот факт, что необработанные изображения STED не содержат артефактов, превратили STED в универсальный метод сверхвысокого разрешения, который совместим с визуализацией живых образцов в дополнение к фиксированным препаратам.
Тем не менее, необходимость уменьшить количество падающего на образец света при одновременном сохранении разрешения и сигнала на высоких уровнях остается всегда. Как и в любом другом методе флуоресцентной микроскопии, качество изображения в конечном итоге определяется фотостабильностью флуоресцентного маркера. Если бы молекулы красителя не обесцвечивались или не переходили в долгоживущие темные состояния, отношение сигнал / шум было бы намного выше, а разрешение ограничивалось бы только размером молекул. Однако на практике изображение всегда представляет собой компромисс между пространственным разрешением, временным разрешением и сигналом.
Адаптивное освещение направляет свет только туда, где это необходимо, путем адаптации освещения к структуре образца. Таким образом, световая доза может быть уменьшена до 100 раз. Экономия может быть вложена в большее количество кадров, большее количество сигнала или лучшее разрешение.
Главный прорыв в этом отношении был сделан с появлением RESCue, DyMIN и MINFIELD, триады методов, которая значительно расширила пределы таких трех параметров как пространственное разрешение, временное разрешение и уровень сигнала. Принцип, лежащий в основе этих трех методов, одинаков, и их часто обозначают термином «адаптивное освещение». Вместо постоянного сканирования на полной мощности образец освещается только в тех местах, где свет может внести положительный вклад в изображение. Другими словами, освещение адаптируется к основной структуре образца. Типичный образец имеет разреженную структуру. Следовательно, соответствующее изображение состоит в основном из фона (расфокусированный свет, автофлуоресценция) или просто темных участков. Имеет смысл не освещать эти области и защитить образец от большей части световой дозы. Кроме того, пропуск темных областей также полезен для участков, которые действительно содержат сигнал, по двум основным причинам. Во-первых, луч возбуждения представляет собой двойной конус (рис. 1). Вдали от фокальной плоскости он становится менее интенсивным, но также и более широким, так что общая интенсивность сохраняется. Поскольку луч возбуждения сканирует образец, фактический фокус попадает в каждую точку только один раз, но конусы постоянно перекрываются, и их интенсивности, хотя и небольшие, в сумме дают ту же интенсивность, что и в фокусе (эффект такой же, как и в фотографии, на которой не в фокусе фон размыт, но не темен). Следовательно, предотвращение излишнего освещения областей, находящихся в фокусе, избавляет области вне фокуса от большого количества света, который в противном случае вызвал бы фотообесцвечивание и фотоповреждение. Это имеет наибольший эффект при записи трехмерных стеков, и это относится как к конфокальной, так и к STED-визуализации.
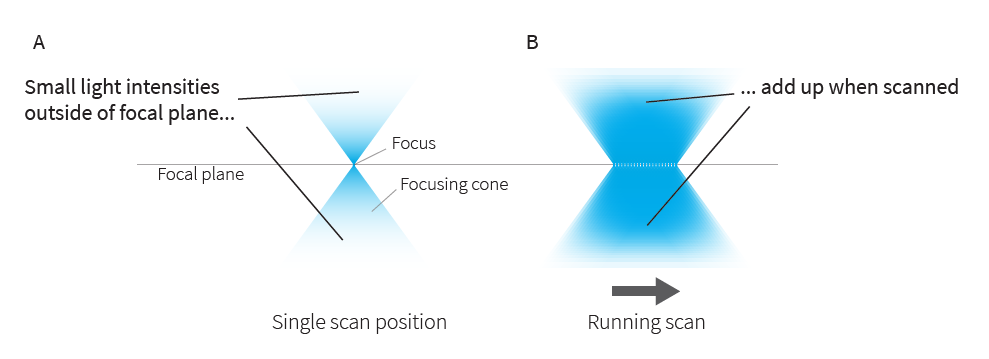
Рис. 1 Небольшие интенсивности вне фокуса складываются во время сканирования
Вторая причина не освещать темные области заключается в том, что фокус лазерного луча - это не бесконечно малая точка, а объем, известный как функция рассеяния точки (ФРТ). В STED микроскопии разница между разрешением и размером ФРТ может быть довольно большой: в то время как микроскопы STED достигают разрешения менее 30 нм даже без адаптивного освещения, сам STED ФРТ по-прежнему ограничен дифракцией и имеет диаметр примерно в десять раз больше этого размера. Следовательно, освещенная область может быть в сто раз больше, чем область, из которой фактически собирается флуоресценция. Это означает, что много раз во время сканирования, когда записывается пустая область, возбуждение и, в частности, STED ФРТ достигают соседних областей, которые содержат флуоресцентные маркеры (рис. 2 A). Эти маркеры подвергаются воздействию высокой интенсивности, но без необходимости, потому что никакие полезные фотоны не могут быть собраны из пустой области. По этим причинам рекомендуется не освещать пустые области в образце, но остается вопрос, как определить, где эти области находятся, не освещая их в первую очередь.
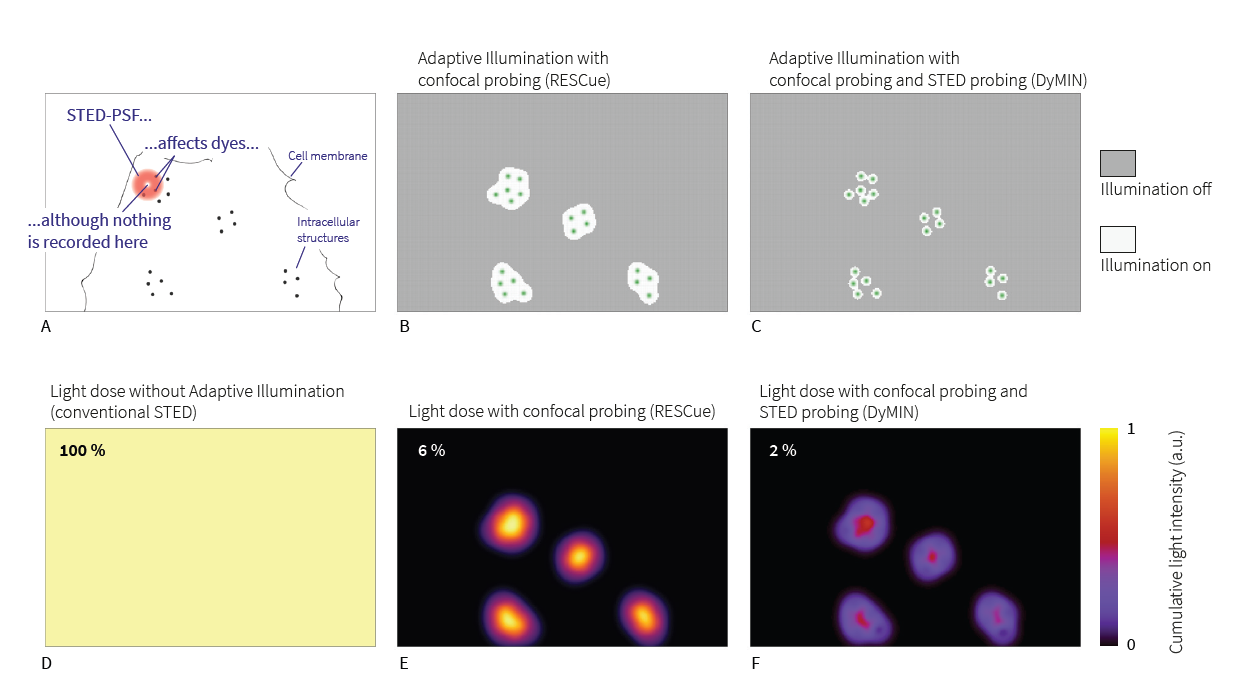
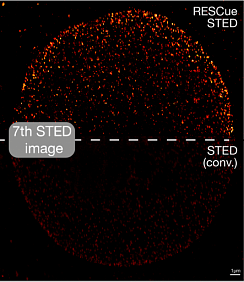
Рис. 2 Дозы света (смоделированные) при визуализации внутренних структур гипотетической клетки (A). Области полного освещения (светло-серый) и только зондирующего освещения (темно-серый) для REScue (B) и DyMIN (C). D: Световая доза при сканировании с постоянной полной мощностью STED, нормализованная до 100%. E: В этом примере дозировка света снижена на 94% и 98%, соответственно, при визуализации с помощью RESCue (E) и DyMIN (F).
Конфокальное зондирование. Метод RESCue
Один из вариантов - сделать быстрое конфокальное изображение с низким уровнем сигнала и повреждениями, установить пороговое значение и использовать его в качестве маски во время финального сканирования, чтобы определить, когда гасить возбуждающий и STED-лазер. Однако потенциальная проблема этого подхода заключается в том, что образец может дрейфовать и / или живой образец может перемещаться между этапом исследования и окончательным сканированием.
Лучше всего зондировать образец точка за точкой, пока идет регистрация данных точка за точкой (рис. 2). Этот подходит приводит к следующей схеме: переход к следующей позиции сканирования, включение возбуждающего луча, ожидание в течение короткого промежутка времени и проверка того, прибыло ли определенное количество флуоресцентных фотонов. Если результат положительный, можно предположить, что флуоресцентные маркеры присутствуют в этой конкретной позиции сканирования, и можно продолжать возбуждать и собирать фотоны до тех пор, пока не будет достигнут желаемый уровень сигнала (конечно, можно также включить STED.) Если на первом этапе зондирования не зарегистрировано ни одного фотона или зарегистрировано только несколько фотонов, эта область, вероятно, пуста, и все лучи выключают на оставшееся время регистрации пикселя. Если образец, скажем, на 80% разрежен, такой метод автоматически и немедленно приводит к тому, что на образец и его флуоресцентные молекулы, которые в настоящее время не в фокусе, попадает на 80% меньше света. Для объемных образцов это может быть решающим различием между хорошим изображением и отсутствием изображения вообще. Кроме того, маркеры в фокусе по второй описанной выше причине дают больше сигнала.
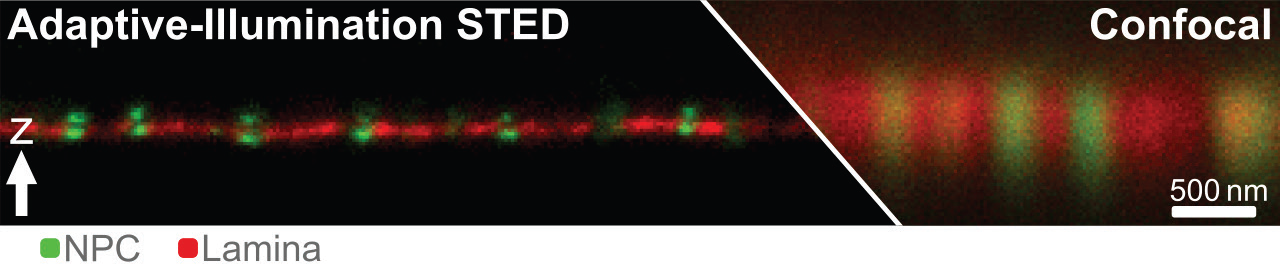
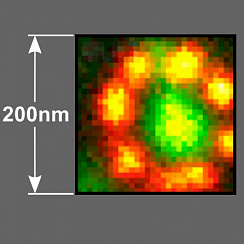
Рис.3 Увеличение разрешения с помощью адаптивного освещения. Два белка (комплекс ядерных пор (NPC) зеленого цвета и ламина красного цвета) вокруг ядерной мембраны были помечены иммуномечением с использованием Abberior STAR Orange и STAR RED. Показаны необработанные данные. Разрешение для NPC изотропно и составляет около 60 нм, это самый высокий показатель разрешения для 3D-STED с обычными флуорофорами, за исключением MINFIELD 3D-STED.
Представленная схема - конфокальное зондирование, за которым следует решение, продолжать визуализацию или нет - известна как RESCue. Для этого требуется быстрое управление освещением в масштабе времени менее микросекунды, обычно обеспечиваемое акустооптическим устройством, и интеллектуальная схема принятия решений, которая надежно отделяет фон от полезного сигнала. Примечательно, что после того, как решение было положительным, визуализация выполняется точно так же, как и раньше, что делает RESCue полностью количественным методом.
Всегда смотрите на светлую сторону флуорофора
Как уже говорилось, размер ФРТ STED обычно составляет несколько сотен нанометров. Когда сканирование приближается к области, содержащей флуоресцентные маркеры, ФРТ STED начинает перекрываться с ним задолго до того, как фактически обнаруживается флуоресценция, которая может исходить только из центра бублика. Метод RESCue помогает справиться с этим, но сам этап конфокального зондирования ограничен дифракцией. Следовательно, когда сканирование происходит в пределах ~ 100 нм от флуоресцентной молекулы, конфокальное зондирование приводит к положительному решению о проведении визуализации и освещение устанавливается на полную, хотя следующий этап STED не дает флуоресценции еще на 70-80 нм по направлению к молекуле. Вскоре после публикации метода RESCue стало ясно, что его можно улучшить, если после начального этапа конфокального зондирования использовать STED для дальнейшего зондирования, теперь уже с субдифракционным разрешением (рис. 2). Это идея, которая лежит в основе метода DyMIN. Фактически, DyMIN использует мульти-STED-зондирование с разной интенсивностью STED - каждый раз, когда сканирование приближается к молекуле, интенсивность STED, используемая на этапе зондирования, немного увеличивается, давая больше информации без применения большей мощности, чем это необходимо. С помощью этого метода можно точно определить границу между пустыми областями и областями, содержащими флуоресцентные маркеры. Что еще более важно, поскольку соотношение между разрешением и мощностью STED следует закону квадратного корня, при низких мощностях STED небольшое увеличение уже дает огромную прибавку в разрешении. Таким образом, зондирование STED-лучом очень малой мощности может значительно улучшить процесс зондирования. Это, а также тот факт, что слишком много шагов зондирования STED увеличивают продолжительность сканирования и совокупную мощность STED, означает, что на практике метод, когда используется схема: один шаг конфокального зондирования, за которым следуют 2-3 шага зондирования STED, является наиболее предпочтительным.
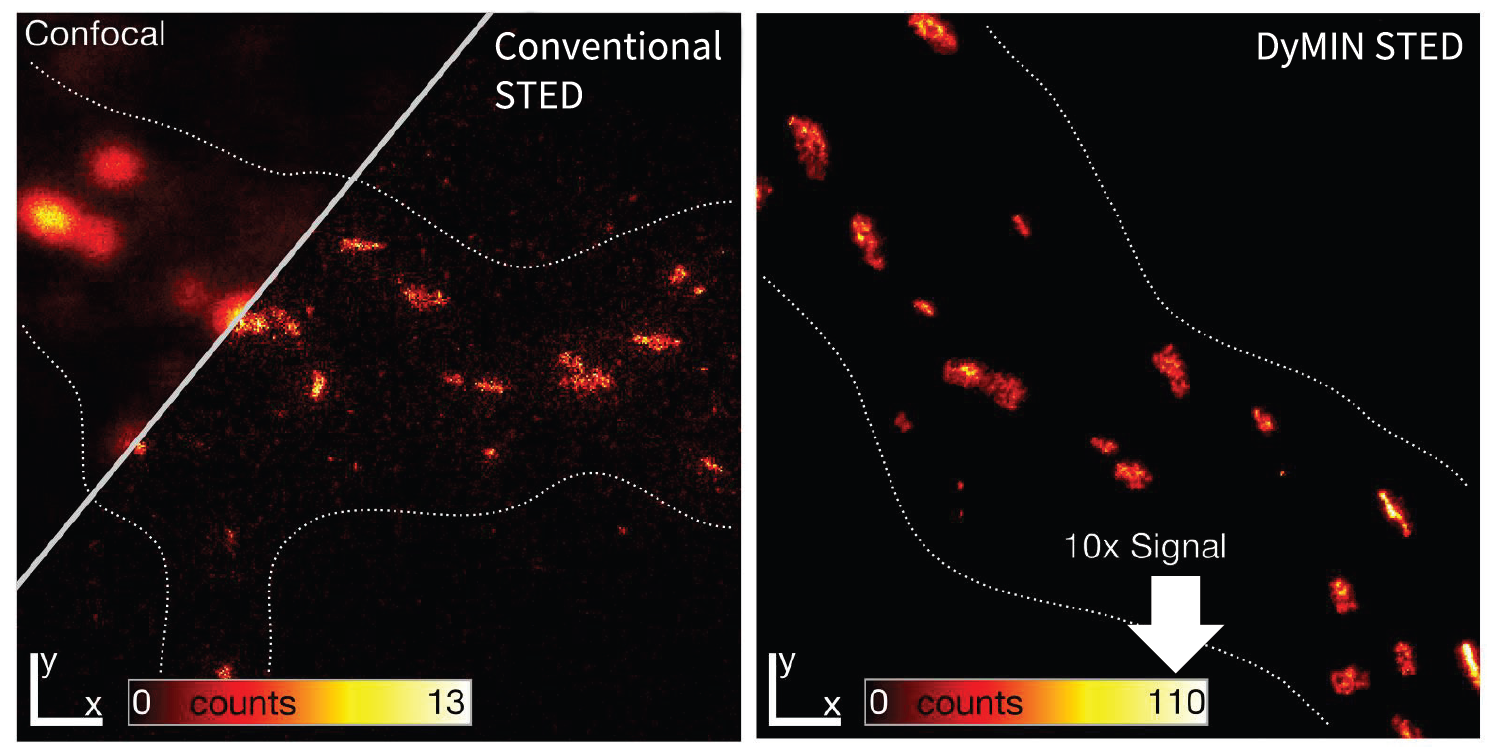
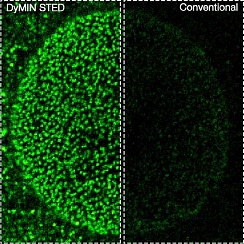
Рис.4 Увеличение сигнала с адаптивным освещением. Слева: конфокальная и стандартная STED-визуализация кластеризации гефирина в ингибирующих синапсах нейронов гиппокампа крыс. Справа: тот же образец, зарегистрированый с помощью DyMIN STED. При прочих равных параметрах сигнал увеличивается в десять раз, уменьшая шум и делая субструктуры четко видимыми, которые невозможно различить с помощью обычного STED метода.
С помощью метода DyMIN дозы света, попадающие на флуоресцентные маркеры и образец, могут быть снижены в 10–100 раз (рис. 2). Это означает, что из одной и той же области можно записать в сто раз больше изображений (рис. 5), сигнал может быть увеличен во много раз (рис. 4) или разрешение может быть улучшено примерно в два-три раза (рис. 3). При этом совокупность таких параметров, как скорость, разрешение и сигнал, которые оператор пытается подобрать для регистрации оптимального изображения, теперь имеют значительно большие пределы и приводят к изображениям, недоступным с помощью обычного STED.
Следует отметить, что DyMIN, в отличие от RESCue, накладывает различные интенсивности света STED на структуры, в зависимости от формы других структур в его окрестностях. Это связано с тем, что с RESCue решение о после зондирования является двоичным, и как только структура была зарегистрирована, она визуализируется с полным освещением. Напротив, с DyMIN для каждого шага сканирования возможно разное количество шагов зондирования, пока решение не станет положительным. Тем не менее, выигрыш, который может быть достигнут с помощью DyMIN, настолько высок, и во многих случаях изображение, где фотообесцвечивание варьируется по образцу, лучше, чем полное отсутствие изображения.
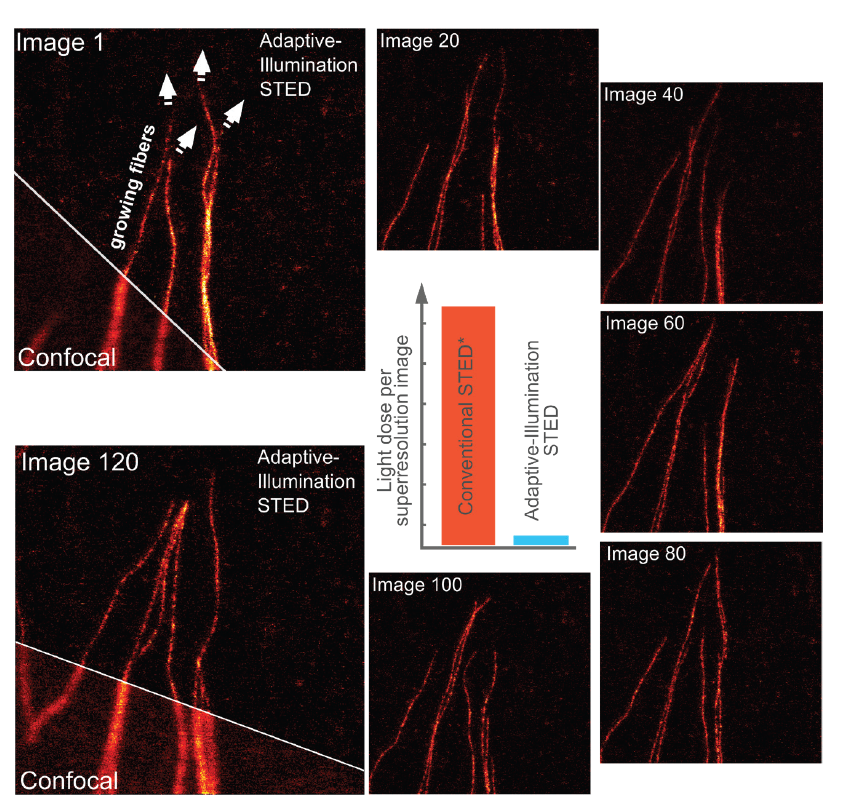
Рис.5 Увеличенное количество кадров для визуализации живых клеток с адаптивным освещением. Гораздо более низкая доза света и слабое фотообесцвечивание облегчают получение изображений живых клеток в режиме таймлапса. 120 изображений одной и той же области образца записываются с разрешением 50 нм без значительного обесцвечивания или стресса для образца. Обратите внимание на растущие волокна тубулина. Вставка показывает снижение световой дозы по сравнению с CW-STED.
На рис. 6 показан нейронный белок PSD95, изображение которого получено с помощью STED с адаптивным освещением и различных препаратов. В (A) фиксированный и иммуноокрашенный срез мозга был получен с высоким сигналом и разрешением. На (C) был получен срез живого мозга с адаптивным освещением STED (красный) и конфокальным контрастным окрашиванием нейронов (зеленый), что дает представление об ориентации PSD95 и субструктуры in vitro.
Минимальная интенсивность для максимального разрешения
Дальнейшее снижение световой дозы может быть достигнуто с помощью немного другой схемы, называемой MINFIELD. Здесь идея состоит в том, чтобы ограничить сканирование только небольшой областью, чтобы не подвергать представляющие интерес флуорофоры воздействию высокоинтенсивного пика STED-бублика. Это означает, что поле зрения должно быть меньше, чем центральная область от нуля до низкой интенсивности STED-бублика, но эта область подвергается только низкой интенсивности и может быть записана с чрезвычайно высоким разрешением, поскольку в значительной степени можно избежать фотообесцвечивания. При использовании MINFIELD было продемонстрировано снижение обесцвечивания до 100 раз, и разрешение около 15 нм, наивысшее разрешение STED было продемонстрировано при использовании обычных флуорофоров. MINFIELD используется для получения максимального разрешения и сигнала от структур размером порядка нескольких сотен нанометров и меньше, таких как вирусы, везикулы, комплексы ядерных пор.
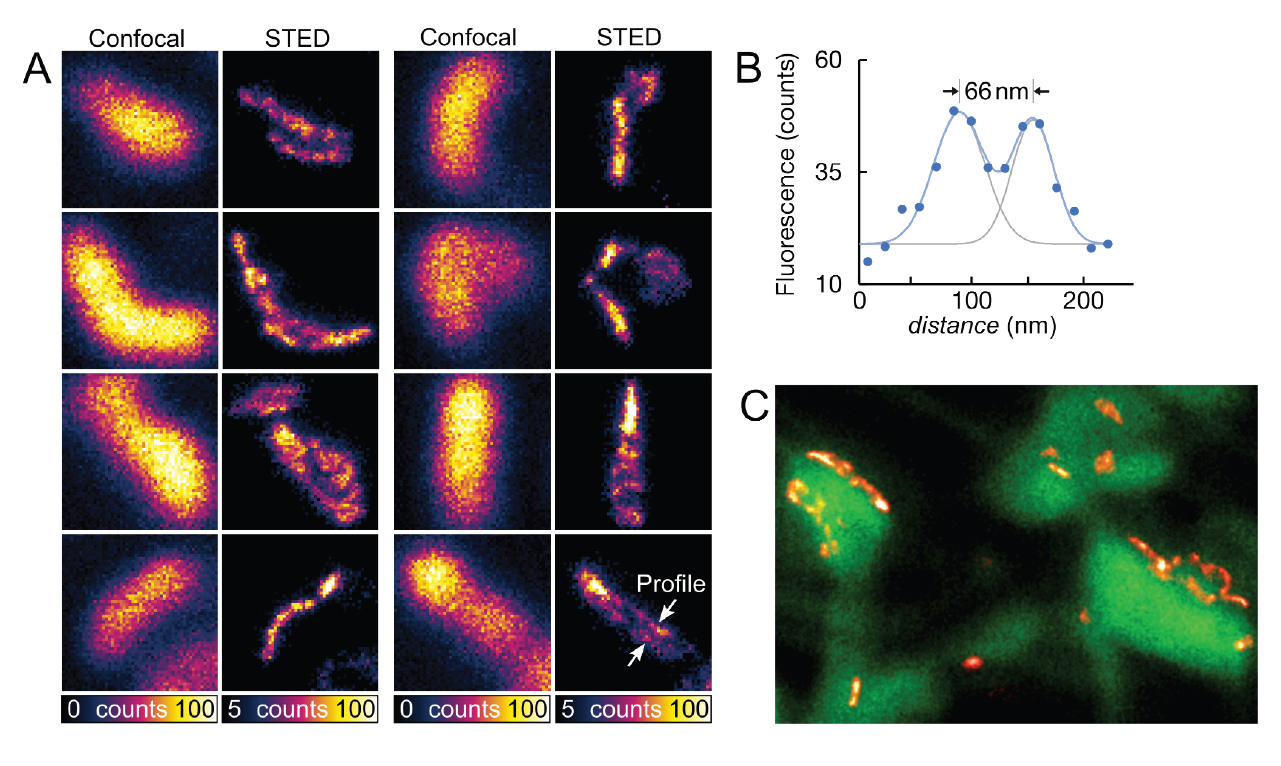
Рис.6 Белок PSD95, изображение которого получено при адаптивном освещении. (A) Фиксированный кластер PSD95 с иммунной меткой. Размер одного изображения составляет 800 нм x 800 нм. (B) Профиль линии, показывающий разрешение профиля, выделенного в (A). (C) Изображение среза мозга живой мыши кластеров PSD95 (красный), полученное с помощью STED с адаптивным освещением и конфокальной визуализацией с контрастной окраской нейронов (зеленый).
Выводы
При адаптивном освещении свет попадает на образец только там, где это необходимо. Поэтому доступ к структурной информации осуществляется по точкам с использованием конфокального и STED зондирования с низкой интенсивностью, чтобы решить, где стоит производить запись данных при полном освещении. Таким образом, воздействие света на образец значительно снижается, что облегчает эксперименты с живыми клетками, получение изображений с высоким разрешением и получение высокого уровня сигнала.
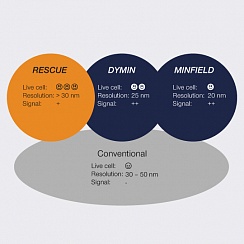
Какой из трех методов адаптивного освещения лучше всего подходит для данного образца, зависит от ряда факторов. Очевидно, что MINFIELD является предпочтительным инструментом для получения изображений STED с очень высоким разрешением и высоким уровнем сигнала структур размером в несколько сотен нанометров. Если структуры становятся больше, можно применить RESCue или DyMIN. Как правило, поскольку RESCue использует только один шаг зондирования, он сохраняет скорость визуализации и лучше всего подходит для быстрой записи и / или экспериментов с живыми клетками.
Разрешение, достигаемое с помощью DyMIN, лучше, однако изображение DyMIN занимает немного больше времени из-за дополнительных шагов зондирования и, следовательно, больше подходит для фиксированных образцов. Тем не менее, DyMIN применялся и к срезам живого мозга (рис. 6C).
Обратите внимание, что концепция адаптивного освещения может быть обобщена. Это не обязательно должен быть этап конфокального зондирования, за которым следует STED. Schlötel и др. использовали RESCue с большим эффектом для визуализации малярийных паразитов, которые накапливают отложения железа на стадии жизненного цикла, протекающей в эритроцитах. Эти частицы гемозоина обладают высокой отражающей способностью, что затрудняет их изучение с помощью конфокальной микроскопии и, в частности, STED-микроскопии. Однако использование низкоинтенсивного конфокального зондирования для локализации и последующего исключения гемозоина во время сканирования позволяет получать многоцветные изображения паразитов малярии на стадии крови с разрешением до 35 нм.