Изобретение оптогенетики позволило ученым использовать свет для активации или отключения нейронной активности отдельных типов клеток с точностью до миллисекунды, чтобы исследовать функцию нейронных цепей. Служа дополнением к оптогенетике, кальциевая визуализация предоставила ученым технологию наблюдения in vivo активности нейронных цепей отдельных типов клеток с клеточным разрешением с использованием флуоресцентных индикаторов.
Интеграция оптогенетики и кальциевой визуализации открывает двери для того, чтобы эти методы выполнялись одновременно в едином эксперименте для исследования причинно-следственной связи между активностью нейронных цепей, функцией и поведением. Вместе, оптогенетика и визуализации кальция, позволяет ученым визуализировать активность нейронов в естественных условиях и, в то же время, нарушать клеточную активность, используя оптогенетику на том же животном.
Для проведения полностью оптических экспериментов как с кальциевой визуализацией, так и с оптогенетикой, ученым требуются оптимизированная биология и новейшие оптические системы.
Оптическая биология
Был разработан широкий спектр оптогенетических зондов, различающихся по функциям (возбуждение или ингибирование), времени активации и свойствам экспрессии.
Оптогенетические зонды возбуждаются длинами волн света, варьирующимися от синего до красного, в зависимости от их свойств. Канал родопсин-2 (ChR2) был выбран оптогенетическим инструментом для возбуждения нервной активности и галородопсином для ингибирования из-за их широкого развития и использования в области оптогенетики.
Оптогенетические зонды имеют только спектр возбуждения, чтобы активировать их возбуждающие / ингибирующие свойства (Yizhar et al. 2011). Напротив, GECIs ведут себя так же, как и флуорофор (например, GFP), так что они демонстрируют спектры возбуждения и излучения. Однако флуоресцентный сигнал GECIs зависит от внутриклеточных концентраций кальция (т. е. повышенного излучения флуоресценции из-за увеличения притока кальция) и демонстрирует динамическое поведение, в отличие от статического сигнала, испускаемого флуорофором (Grienberger & Konnerth 2012).
Исследователи обычно предлагают использовать GCaMP для визуализации и канал родопсин-2 (ChR2) для оптогенетики во всех оптических экспериментах из-за оптимизации, эффективности и частого использования этих биологических зондов.
Однако с комбинацией GCaMP и ChR2 возникает проблема, их спектры возбуждения перекрываются (пиковая длина волны ~470 нм). Когда GCaMP и ChR2 экспрессируются в одной и той же ткани, световое возбуждение для визуализации кальция потенциально может активировать и оптогенетический зонд. Таким образом, GCaMP визуализации и ChR2 стимуляции оптогенетики не может быть выполнена одновременно из-за возможных оптических помех. Невозможно определить, вызваны ли измеренные изменения сигнала GCaMP естественными изменениями нервной активности или оптогенетическими изменениями.
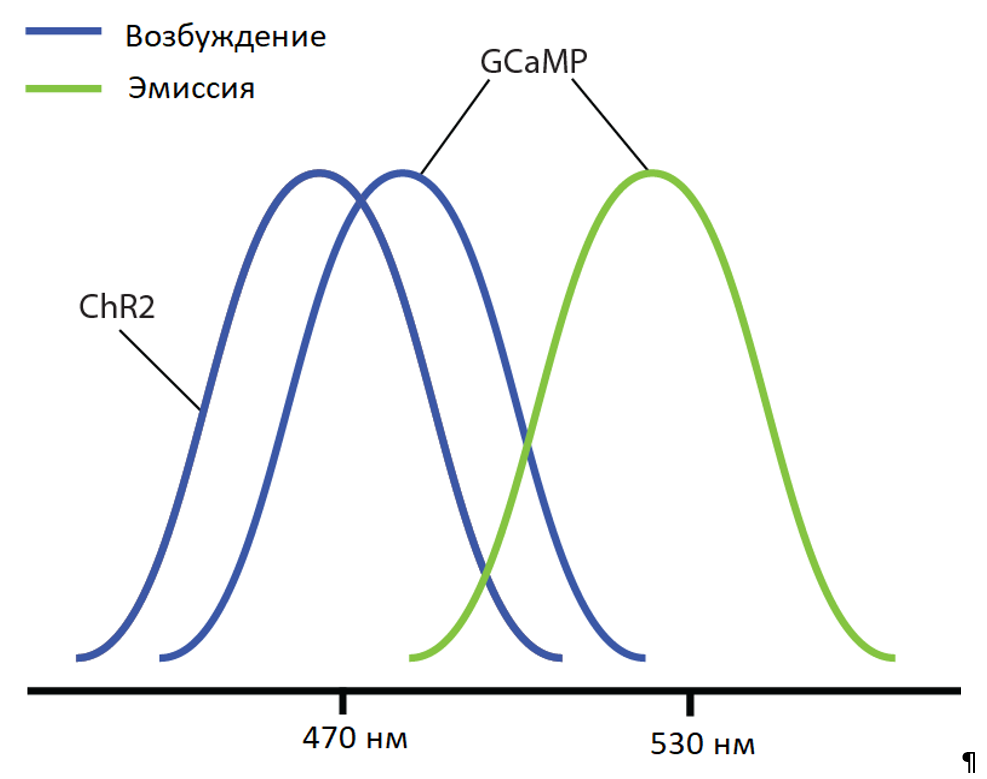
Перекрытие между спектрами возбуждения GCaMP и ChR2
Оптические перекрестные помехи во всех оптических экспериментах могут быть уменьшены путем выбора индикаторов визуализации и оптогенетических зондов с неперекрывающимися спектрами возбуждения (Emiliani et al. 2015).
Примеры комбинаций с пониженными оптическими перекрестными помехами - синий спектр возбуждения/зеленый эмиссионной спектр для визуализации (например, GCaMP) и оптогенетики с красным смещением (например, Chrimson, Jaws); или зеленый спектр возбуждения /красный эмиссионной спектр (например, RCaMP) для визуализации и оптогенетики с синим смещением (например, ChR2, GtAChR). Хотя между спектрами возбуждения этих зондов может быть некоторое перекрытие, вероятность перекрестных помех будет уменьшена, предотвращая косвенную активацию вашей оптогенетической конструкции во время визуализации.
Дальнейшая оптимизация зондов визуализации и оптогенетики (например, чувствительность, спектры возбуждения) поможет предотвратить оптические перекрестные помехи во всех экспериментах по оптической оптогенетике и визуализации кальция.
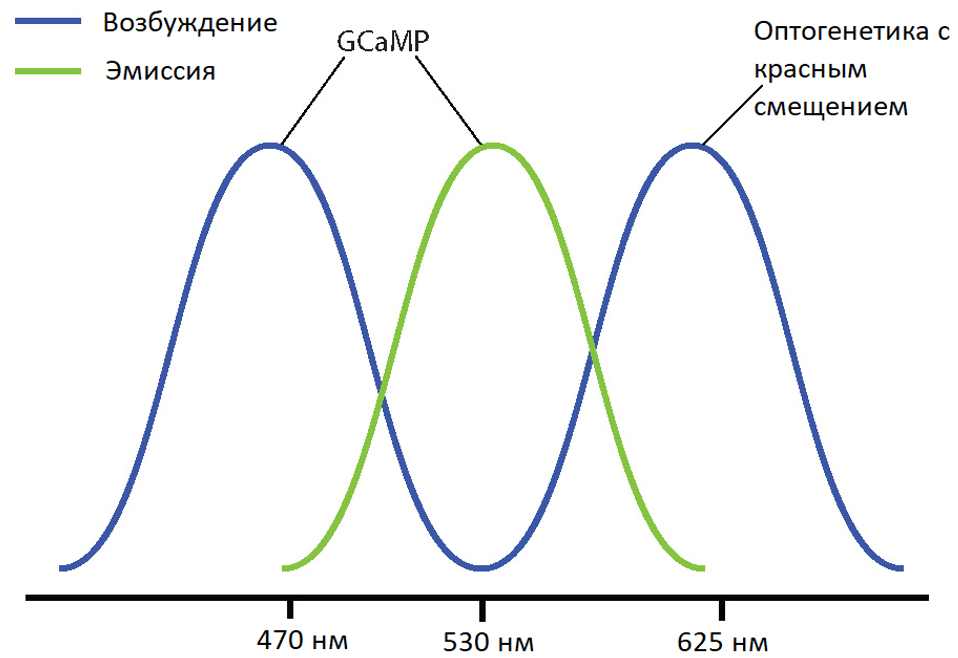
Разделение спектров возбуждения GCaMP и оптогенетикой с красным смещением
Оптические системы
1. Волоконная фотометрия
Оптогенетика может быть интегрирована в эксперименты по волоконной фотометрии. Единственное дополнительное оборудование, которое требуется, - это соответствующий светодиод для оптогенетической стимуляции и набор фильтров для объединения со светодиодом для визуализации кальция. Пример включает добавление красного светодиода для оптогенетики с красным смещением и визуализации GCaMP (Kim et al. 2016).
Подобно кальциевой визуализации с помощью волоконной фотометрии, оптогенетическая стимуляция может быть выполнена только в широкой зоне, стимулируя все нейроны без клеточного разрешения.
Ключевой особенностью волоконной фотометрии является возможность выполнения мультизональной оптогенетики в сочетании с мультизональной кальциевой визуализацией; однако в этой установке из-за технических ограничений оптогенетическая стимуляция не может проводиться в одной выбранной области одновременно, а вместо этого освещает все области одновременно (Kim et al. 2016).
Волоконная фотометрия - это очень упрощенный метод для проведения популяционных оптических кальциевых изображений и экспериментов по оптогенетике в одной или нескольких областях мозга.
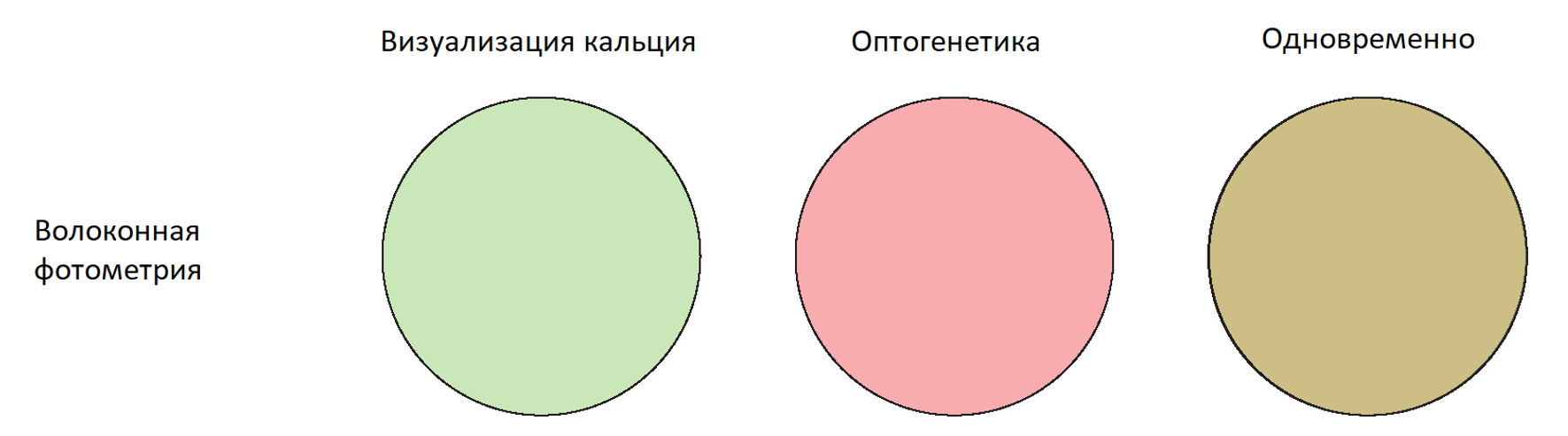
Волоконные фотометрические системы не обеспечивают клеточного разрешения для визуализации кальция или оптогенетики.
2. Минископ
Недавно, минископы интегрировали с оптогенетикой (Stamatakis et al. 2018). Это требует дополнительного светодиода и соответствующего набора фильтров для сбора корректного сигнала. В отличие от волоконной фотометрии, светодиод и фильтр непосредственно интегрированы в минископ (вес 2~3 г), и это создает дополнительный вес на голове животного.
Из-за невозможности интеграции с осветителем DMD или лазерным сканером минископы ограничены выполнением широкополевой оптогенетики без клеточного разрешения. Минископы могут быть использованы для визуализации отдельных нейронов с клеточным разрешением, но они могут только оптогенетически стимулировать все клетки.
Кроме того, минископы также ограничены выполнением оптогенетики и визуализации в одной области мозга из-за относительно громоздких размеров и большого веса системы.

Системы с минископом обеспечивают клеточное разрешение для визуализации кальция, но не для оптогенетики
3. Оптический волоконный эндоскоп
По сравнению с оптическими системами, описанными выше, оптический фиброскоп (например, система OASIS Implant от компании Mightex) является чрезвычайно гибкой системой для оптической визуализации кальция и оптогенетики. Эта система может быть легко модернизирована оптогенетическими возможностями, с помощью добавления соответствующий комбинация светодиодов и фильтров.
По сравнению как с минископом, так и с волоконной фотометрией, оптический фиброскоп может не только выполнять широкопольную оптогенетику, но и, интегрируя цифровое зеркальное устройство (DMD), использоваться для оптогенетики клеточного разрешения in vivo. Оптический фиброскоп - это единственная свободно действующая система, способная как к визуализации кальция с клеточным разрешением, так и к оптогенетике с клеточным разрешением у свободно двигающегося животного. Ученые могут проводить эти эксперименты в мозге на глубине или на большой площади коры головного мозга.
Для более широкого поля зрения или более мощных применений лазеры (вместо светодиодов) могут быть использованы для оптогенетики с помощью оптического волоконного микроскопа.
Исследователи могут выполнять визуализацию кальция с клеточным разрешением и оптогенетику в нескольких зонах одновременно, используя расщепленное волокно с оптическим фиброскопом. Например, можно стимулировать несколько отдельных нейронов или выбранную группу нейронов в одной области и визуализировать отдельные клетки в другой, что невозможно в случае волоконной фотометрии или минископа.
Оптический фиброскоп - это мощная полностью оптическая система визуализации и оптогенетики, способная как к оптогенетике клеточного разрешения, так и к визуализации клеточного разрешения в одной или нескольких областях мозга одновременно.
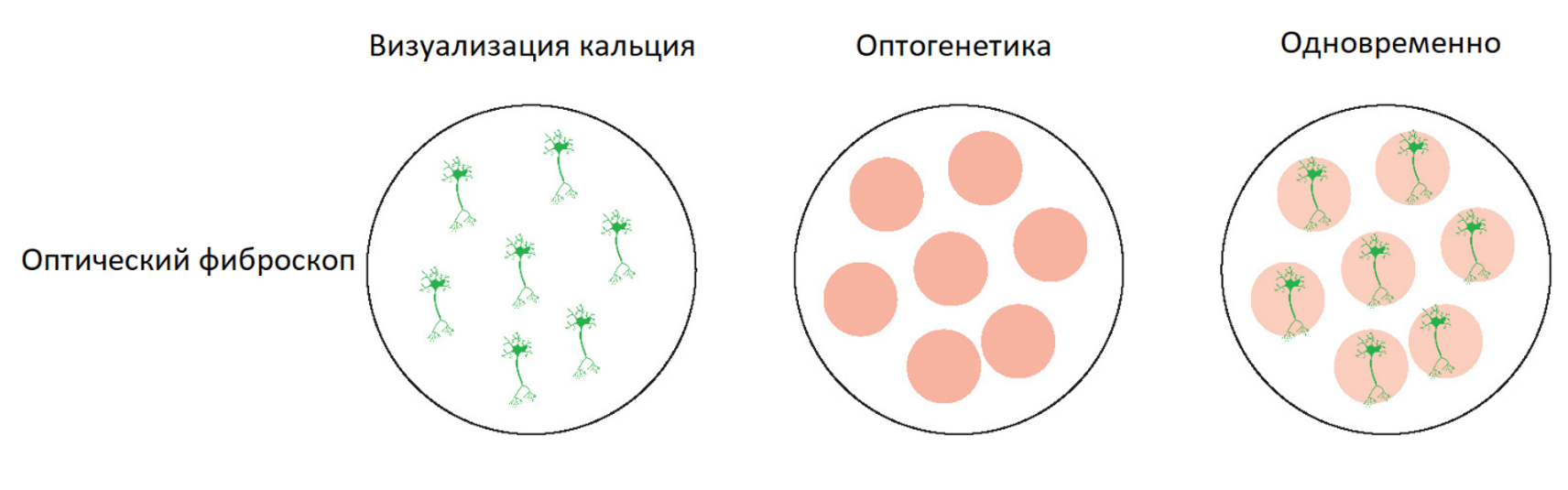
Оптические волоконные системы обеспечивают клеточное разрешение для визуализации кальция и оптогенетики
Таблица сравнения систем
|
|
Волоконная фотометрия |
Минископ |
Оптический эндоскоп (OASIS Implant) |
|
Визуализация с клеточным разрешением |
Нет |
Да |
Да |
|
Оптогенетика с клеточным разрешением |
Нет |
Нет |
Да |
|
Мультизональная визуализация с клеточным разрешением и оптогенетика |
Нет |
Да |
Да |












