Ведение
Цель любого микроскопа – создавать высококонтрастные изображения с высоким разрешением. Подобно тому, как телескоп позволяет человеку различать мельчайшие детали Вселенной, микроскоп позволяет наблюдать биологические процессы в нанометровом масштабе. Современные лазерные сканирующие микроскопы способны генерировать многомерные данные (X, Y, Z, τ, λ), что приводит к множеству возможностей визуализации высокого разрешения, которые способствуют пониманию основных биологических процессов. На рисунке 1 представлена классическая схема широкопольного микроскопа.
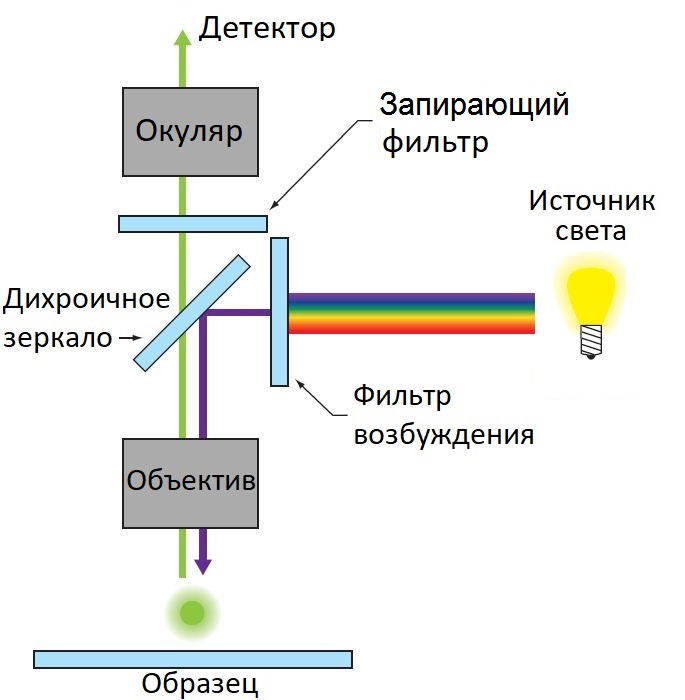
Рис. 1 Схема широкопольного микроскопа для эпифлуоресцентной микроскопии
Реализация данной схемы позволяет получить высококачественные изображения только при использовании тонких образцов (толщиной порядка одного-двух слоев клеток). Однако, во многих приложениях требуются объемные наборы данных или выбор данных из конкретной фокальной плоскости, т.е. необходима визуализация толстых образцов. Обычные широкоугольные микроскопы не способны удовлетворить эти потребности.
Усовершенствование лазерной сканирующей микроскопии (LSM) до конфокальной или многофотонной системы, позволяет визуализировать тонкие плоскости из толстого объемного образца (метод оптического сечения). На рисунке 2 представлен принцип построения изображения образца в конфокальной и многофотонной системах.
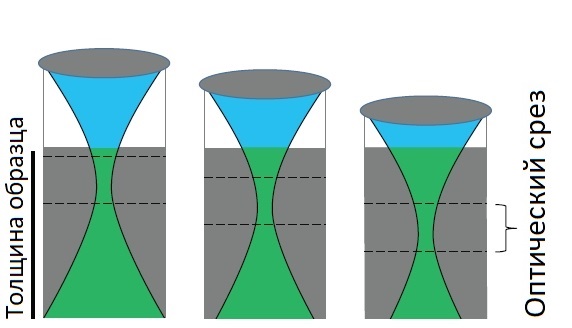
Рис. 2а Получение изображений тонких слоев внутри образца (оптические срезы) - конфокальная микроскопия
В конфокальной системе сигналы, генерируемые образцом вне оптического фокуса, обрезаются точечной диафрагмой (обычно она размещается в плоскости формирования изображений), в результате на матрицу приходит сигнал только из фокальной плоскости объектива.
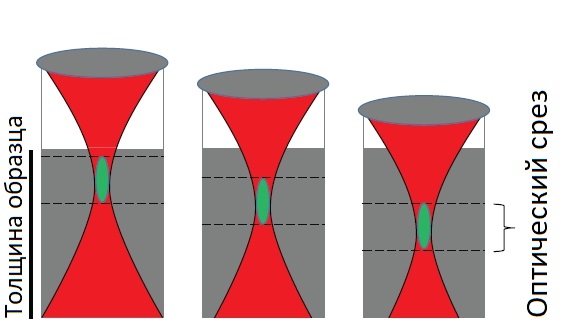
Рис. 2б Получение изображений тонких слоев внутри образца (оптические срезы) - мультифотонная микроскопия
В многофотонной системе происходит возбуждение флуоресцентной метки непосредственно в точке фокусировки, что позволяет отказаться от использования диафрагмы, используемой в конфокальной системе. Именно за счет комбинирования визуализации тонких плоскостей с изменениями фокуса, методы лазерной сканирующей микроскопии позволяют воссоздать трехмерное представление толстого образца.
1. Методы контрастирования в лазерной сканирующей микроскопии
Биологические образцы обычно имеют недостаточный уровень контраста, что приводит к трудностям в исследовании структур этих образцов. Одним из эффективных методов улучшения контрастности в лазерных сканирующих микроскопах является использование флуоресценции.
При флуоресценции светоизлучающая молекула заметна на фоне других молекул, составляющих общую структуру. Если исследуемый образец не содержит такие молекулы (эндогенные флуорофоры), их внедряют в ткань извне – химически или путем трансфицирования флуоресцентных белков в клетку.
Чтобы молекула флуоресцировала, она должна поглотить фотон с соответствующим количеством энергии, достаточным для перехода молекулы из основного в возбужденное состояние. Схематическое изображение данного процесса показано на рисунке 3а.

Рис. 3 Генерация сигналов в лазерной сканирующей микроскопии
При вынужденном переходе молекулы из возбужденного состояния в состояние равновесия она испускает квант света. За счет естественных потерь в процессе релаксации излучаемый фотон имеет меньшую энергию и, соответственно, большую длину волны, чем поглощенный фотон. Количество флуоресценции пропорционально интенсивности (I) лазерного излучения, освещающего образец, поэтому лазерную конфокальную микроскопию часто называют методом линейной визуализации.
Многофотонное возбуждение молекулы (рисунок 3б) происходит, когда два (или более) фотона, энергии которых в сумме удовлетворяют количеству энергии, необходимой для квантового перехода, поглощаются одновременно. При этом два поглощенных фотона будут иметь меньшую энергию, чем излучаемый флуоресцирующий фотон.
Также существуют схемы многофотонного контрастирования (рисунок 3в), такие как генерация гармоник и генерация суммарной частоты. Эти процессы не требуют поглощения энергии. При генерации гармоник падающие фотоны аннигилируют, после чего создается новый фотон, обладающий суммарной энергией. Исследование в таком случае происходит путем наблюдения за физическим порядком генерации гармоник. Так, генерация второй гармоники (ГВГ) наблюдается только в составных элементах, которые сильно упорядочены и не имеют инверсионной симметрии, а генерация третьей гармоники (ГТГ) наблюдается на границах кристаллов, где происходит изменение показателя преломления.
Двухфотонное возбуждение и генерация второй гармоники – нелинейные процессы, так как излучение зависит от квадрата интенсивности (I2). Это означает, что для исследования генерации второй и третьей гармоник необходимы высокие плотности фотонов. Для достижения необходимой плотности нужно использовать мощные источники лазерного излучения, часто применяются фемтосекундные импульсные лазеры с фазовой синхронизацией (например титан-сапфировые).
Еще одна отличительная особенность линейной микроскопии – это определенная длина волны для возбуждения конкретного флуорофора. Для возбуждения большинства флуорофоров требуются различные длины волн при одно- и двухфотонном поглощении. Существуют отдельные спектры для этих видов поглощения, спектры двухфотонного поглощения часто значительно шире (> 100 нм) и не соответствует гладким полугауссовым кривым. Широкий спектр двухфотонного поглощения многих флуорофоров позволяет возбуждать несколько флуоресцентных молекул одним источником лазерного излучения, что делает возможным одновременное наблюдение флуоресценции от нескольких флуорофоров с разной длинной волны возбуждения.
Возбуждаемые в образце флуорофоры могут иметь разный пик возбуждения, но необходимо, чтобы пересекались длины волн их возбуждения. В большинстве случаев возбуждение нескольких флуорофоров достигается подбором компромисного источника излучения, длина волны которого возбуждает все флуорофоры и обеспечивает необходимый уровень их эффективности.
2. Формирование изображения
В LSM с точечным сканированием изображение в одной плоскости создается точечным источником освещения, отображаемым в ограниченном дифракцией пятне на образце, которое затем передается на детектор. Двумерные изображения строятся с помощью массива данных, полученных путем сканирования образца, точка за точкой, чтобы сформировать линию, а затем линию за линией растровым способом.
Освещаемый объем излучает сигнал, который передается на одноэлементный детектор. Наиболее распространенным одноэлементным детектором является фотоумножитель (ФЭУ), в редких случаях могут использоваться лавинные фотодиоды. ПЗС-камеры обычно не используются в микроскопах с точечным сканированием, но широко применяются в конфокальных системах с многолучевым типом сканирования (конфокальная система, в которой для сканирования образца используются диски Нипкова).
Сигнал от детектора передается на компьютер, который строит двумерное изображение в виде массива интенсивностей для каждого пятна. Поскольку реальное изображение не формируется, LSM метод называют технологией цифровой визуализации изображения. Очевидное преимущество сканирования и распознавания по одной точке в том, что разрешение изображения и поле сканирования можно настраивать в соответствии с конкретными условиями эксперимента, независимо от технических характеристик системы визуализации.
Лазерная конфокальная сканирующая микроскопия (LCSM)
Рассмотрим метод лазерной сканирующей конфокальной микроскопии более детально. На рисунке 4 представлена классическая схема конфокального микроскопа.
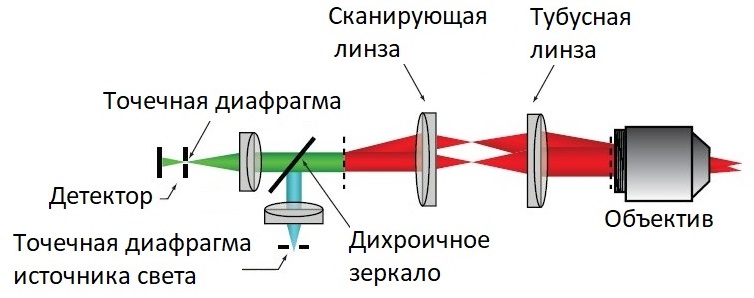
Рис. 4 Схема оптический системы конфокального микроскопа
В конфокальных лазерных микроскопах используется точечная подсветка от одномодового оптоволоконного непрерывного лазера. Лазерное излучение коллимируется и используется для подсветки сканируемого образца. Свет от образца попадает на объектив и проходит через сканирующую систему на детектор. Перед детектором размещена точечная диафрагма (пинхол), ограничивающая прохождение на датчик излучения не из фокальной плоскости. Меняя диаметр пинхола можно регулировать контрастность, разрешение и толщину оптического среза. После прохождения через сканирующую систему, луч лазерной подсветки попадает на дихроичное зеркало, а затем фокусируется.
Разрешающая способность конфокального микроскопа в боковом направлении зависит от характеристик пятна с ограничением дифракции, с помощью которого и осуществляется сканирование. А характеристики пятна, в свою очередь, определяются качествами лазерного излучения, сканирующей оптики и свойствами объектива.
В качестве источника света возбуждения в основном используют одномодовый оптоволоконный лазер. Луч коллимируется и фокусируется в пучок, ограниченный дифракцией. В системе формирования изображений без аберраций, полученной с использованием оптических элементов высокого качества, размер пятна фокусировки (при условии равномерного освещения) является функцией длины волны возбуждающего излучения и числовой апертуры объектива:
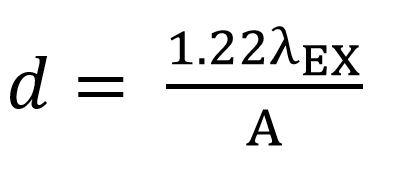
Уравнение 1. Размер пятна фокусировки
где λEX – длина волны возбуждающего излучения, А – числовая апертура объектива.
Лазерный луч фокусируется в точку, вокруг которой наблюдаются концентрические кольца. Таким образом, размер пятна – это расстояние между нулями диска Эйри (диаметр от центра пятна до середины первого кольца) и измеряется в относительных единицах, называемых Airy Unit (AU).
Латеральное разрешение (оси x, y) системы формирования изображения определяется как минимальное расстояние между двумя точками, когда они еще наблюдаются как два разных объекта. При работе на конфокальных (или многофотонных) микроскопах принято латеральное разрешение считать, как величину ширины на полувысоте (FWHM). Формула для вычисления латерального разрешения примет вид:
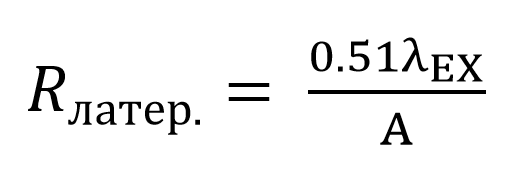
Уравнение 2. Латеральное разрешение - конфокальная лазерная сканирующая микроскопия
Аксиальное разрешение (ось z), фокальное пятно представляет собой эллиптической формы пятно, известное как функция рассеяния точки (ФРТ), вычисляется по формуле:
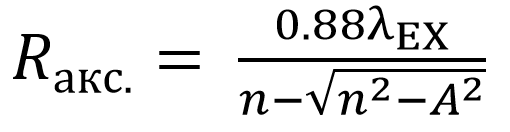
Уравнение 3. Аксиальное разрешение - конфокальная лазерная сканирующая микроскопия
где n – показатель преломления иммерсионной среды объектива.
Следует отметить, что в отличие от широкопольных микроскопов, где разрешение по поверхности зависит только от длины излучения, в конфокальных лазерных системах латеральное разрешение определяется длиной возбуждающего излучения. Чтобы определить размер конфокального отверстия, нужно умножить размер пятна возбуждения на общее увеличение микроскопа:
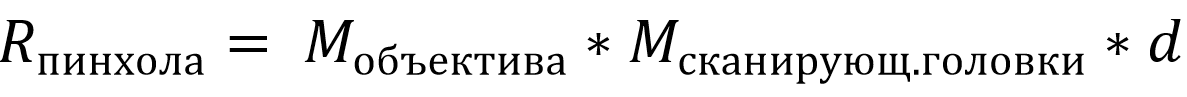
Уравнение 4. Диаметр пинхола
где Мобъектива – увеличение объектива, Мсканир.головки – увеличение скнанирующей головки, d – размер пятна.
Пример 1.
Размер пинхола для объектива с 60-кратным увеличением с числовой апертурой объектива A = 1.0 и длиной волны возбуждающего излучения λEX = 488 нм (M сканирующ.головка = 1.07 для объективов Thorlabs) будет составлять 38,2 мкм:
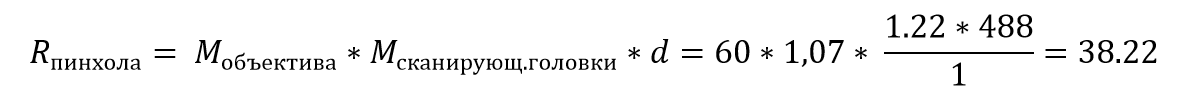
То есть используется пинхол диаметром 1 Airy Unit. Если эти же значения применить для объектива с 40-кратным увеличением, то размер пинхола составил бы 25.5 мкм, такая диафрагма тоже называлась бы отверстием диаметром в 1 АU, так как единицы AU – относительны и принимаются за стандарт системы. Следовательно, определение диаметра отверстия в виде AU является средством нормализации диаметра отверстия, даже если бы пришлось изменить выбор отверстия для двух разных целей.
Теоретически общая разрешающая способность конфокального микроскопа определяется как функция от размера пятна подсветки и диаметра пинхола. Это означает, что разрешение всей оптической системы можно увеличить, уменьшая диаметр пинхола. Однако на практике, уменьшение размера точечной диафрагмы приводит не только к увеличению разрешения, но и к уменьшению количества излучения, дошедшего до детектора. Поэтому оптимальным размером пинхола считается величина в 1 AU – в данном случае достигается наилучшее соотношение между качеством сигнала, разрешением и софокусностью.
Мультифотонная лазерная сканирующая конфокальная микроскопия (MLCSM)
Рассмотрим метод многофотонной лазерной конфокальной микроскопии более подробно. На рисунке 5 представлена схема мультифотонного микроскопа.
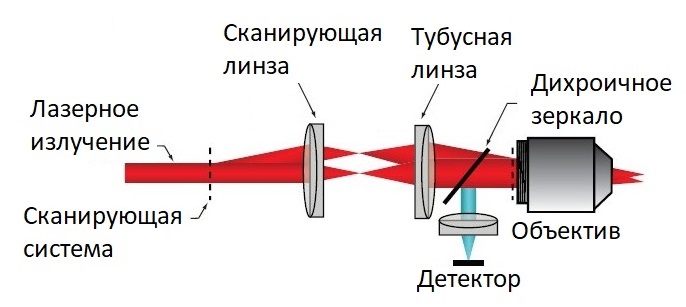
Рисунок 5 – Схема оптической системы мультифотонного микроскопа
В многофотонных сканирующих системах используется короткоимпульсный лазер, излучающий коллимированный пучок, который проходит через систему сканирования и фокусируется объективом. В таких системах вероятность возникновения многофотонного поглощения очень низка, это связано с квадратичной зависимостью сигнала (I2) от мощности падающего излучения. Таким образом появление сигнала ограничено фокальной плоскостью линзы объектива и вне фокальной плоскости излучения он практически отсутствует, что позволяет осуществлять оптическое секционирование без точечной диафрагмы в схеме. Полученный от образца сигнал не должен возвращаться через сканирующую систему, что позволяет размещать детектор максимально близко к объективу и максимизировать эффективность регистрации сигнала.
Латеральное разрешение (оси x, y) мультифотонной микроскопической системы определяется по формуле:
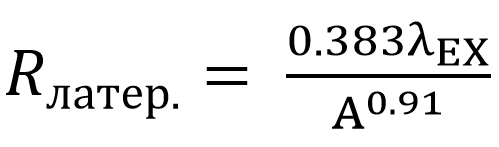
Уравнение 5. Латеральное разрешение - мультифотонная лазерная сканирующая микроскопия
где λEX – длина волны возбуждающего излучения, А – числовая апертура объектива.
Аксиальное разрешение (ось z), мультифотонной микроскопической системы определяется по формуле:
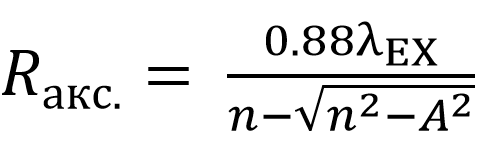
Уравнение 6. Аксиальное разрешение - мультифотонная лазерная сканирующая микроскопия
где n – показатель преломления иммерсионной среды объектива.
Данные уравнения справедливы для объективов с числовой апертурой (A) > 0.7, практически во всех многофотонных сканирующих системах используются объективы со значением числовой апертуры, удовлетворяющим данному условию.
Из уравнения 6 можно сделать вывод, что по сравнению с конфокальными микроскопами увеличение длины волны возбуждающего излучения в многофотонных системах ведет к уменьшению разрешения почти в 2 раза.
Следует так же отметить, что существует зависимость латерального и аксиального разрешения системы от интенсивности излучения. Так, по мере увеличения мощности лазерного излучения растет вероятность генерации сигнала внутри фокального объема с ограничением дифракции. На практике поверхностное разрешение в многофотонных сканирующих микроскопах достигает предельного значения, когда луч подсветки максимально сфокусирован и приближен эмпирически уравнением 6 при умеренной интенсивности. По мере увеличения мощности возбуждающего излучения осевое разрешение будет ухудшаться.
3. Параметры изображения
Несмотря на то, что в лазерной микроскопии не происходит прямой визуализации, при обработке изображений, необходимо правильно рассчитать размер поля изображения, разрешение захвата и разрешение по плоскости. Разрешающая способность в поперечном направлении важна при визуализации анфас-проекции исследуемого образца. Для более точного отображения всех деталей необходимо правильно подобрать разрешение как при захвате, так и в боковом направлении поля сканирования. Разрешение захвата должно соответствовать оптическому разрешению.
В лазерной микроскопии обычно используется правило Найквиста, где размер пикселя определяется боковым разрешением, разделенным на 2,3.
Пример 2.
Для объектива с 60-кратным увеличением боковое разрешение составляет 249 нм (уравнение 2), а размер пикселя в конечном изображении составляет 108 нм. Поэтому для разрешения захвата 1024×1024 пикселей поле сканирования составит примерно 111 мкм×111 мкм. При этом объектив с 40-кратным увеличением (Пример 1) даст те же размеры поля сканирования (оба объектива имеют одинаковое раскрытие) в выборке. Единственное различие между двумя изображениями – это угол наклона сканеров.
Следует отметить, что высокое разрешение при обработке изображений требуется далеко не всегда. Существуют альтернативные настройки системы, применяя которые можно получать качественные и точные изображения.
4. Визуализация в исследованиях живых клеток
Одним из значимых применений методов лазерной микроскопии является исследование живых клеток и тканей. Однако, следует помнить, что некоторые побочные эффекты флуоресценции могут быть цитотоксичными для исследуемого образца. Поэтому, необходимо соблюдать ряд требований, чтобы сохранить точность исследования без вреда для биологического образца.
Важную роль во флуоресцентной микроскопии играет насыщение флуорофора. Насыщение происходит, когда в ответ на увеличение мощности лазера не происходит увеличения флуоресцентного излучения. Это случается, когда 10% флуорофоров находятся в возбужденном состоянии. Время насыщения – это время, в течение которого флуорофор переходит в основное состояние после первого возбуждения. Скорость реакции флуоресценции относительно велика и составляет от сотни пикосекунд до нескольких наносекунд, в то время как преобразование триплетного состояния белка и безызлучательный распад требуют значительно большего времени для перехода в основное состояние. Кроме того, повторное возбуждение флуорофора до того, как он перейдет в основное состояние, может привести к необратимому фотообесцвечиванию флуорофора. При медленном возбуждении клетки могут задействовать собственные внутренние механизмы для борьбы с цитотоксичностью от флуоресценции.
Одним из способов уменьшения фотообесцвечивания и связанной с ним цитотоксичности является быстрое сканирование. Уменьшив количество времени, затрачиваемого лазером на одну точку изображения, пропорционально уменьшается и количество излучения. Процессы фотообесцвечивания замедляются, так как флуорофор может перейти в основное состояние до следующего сканирования. Если скорость не является основным требованием, можно повысить точность, усредняя или объединяя снимки.
Увеличение длины волны возбуждения и возможность неконфокального детектирования в многофотонной лазерной микроскопии расширяют возможности исследований биоткани. Длинные волны менее восприимчивы к рассеянию на образце из-за обратной энергетической зависимости четвертой степени (I-4) рассеяния на длине волны. Обычно глубина проникновения для многофотонного лазерного микроскопа составляет 250-500 мкм (хотя в литературе были найдены значения около 1 мм), а для конфокального около 100 мкм.











