Введение
Микроскопия с двухфотонным возбуждением (также называемая нелинейной, мультифотонной или двухфотонной лазерной сканирующей микроскопией) является альтернативой конфокальной микроскопии и микроскопии с деконволюцией, которая имеет определенные преимущества при получении трехмерных изображений. В частности, двухфотонное возбуждение превосходит другие методы визуализации при наблюдении живых клеток, особенно тканей, таких как срезы мозга, эмбрионы, целые органы и, даже, целые животные. Эффективная чувствительность флуоресцентной микроскопии, особенно при наблюдении толстых образцов, ограничена излучением, генерируемый областями вне фокуса системы. Влияние данного явление уменьшается в конфокальной микроскопии путем использования точечной диафрагмы (пинхола) для отсечения флуоресценции от областей вне фокуса и получения тонких (меньше 1 микрометра) неразмытых оптических срезов. В микроскопии с деконволюцией используется традиционный микроскоп и цифровая обработка изображения для реконструкции с помощью функции рассеяния точки оптической системы.
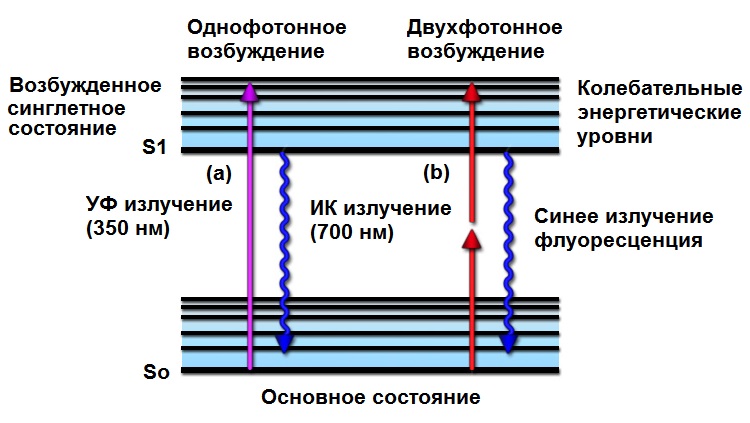
Рис. 1 Диаграмма Яблонского. Двухфотонное возбуждение
В этой статье обсуждаются основные принципы микроскопии мультифотонного возбуждения, преимущества и недостатки использования данного метода в лазерной сканирующей микроскопии. Чтобы показать эффективность этого метода и продемонстрировать его ограничения рассмотрение ведется с практической точки зрения. В конце представлены некоторые эксперименты, проведение которых стало возможным лишь благодаря двухфотонной микроскопии.
Перед проведением эксперимента с получением оптического среза необходимо внимательно подойти к выбору методики, которая подойдет лучше всего для решения поставленной в исследовании задачи. При использовании флуоресцентной микроскопии для изучения толстых образцов, двухфотонное возбуждение часто является наиболее подходящим решением, хотя в определенных экспериментах методы трехмерной флуоресцентной микроскопии будут являться дополнительным преимуществом.
Конфокальная микроскопия использует точечное отверстие (пинхол), чтобы исключить регистрацию флуоресценции от областей за пределами фокуса. Таким образом, этот метод позволяет получать трехмерные оптические срезы на более толстых тканях. Однако свет возбуждения генерирует флуоресценцию и, таким образом, вызывает фотообесцвечивание и фототоксичность по всему образцу, даже если сигнал собирается только из плоскости фокуса. Этот большой объем возбуждения может вызвать значительные проблемы с фотообесцвечиванием и фототоксичностью, особенно у живых образцов. Кроме того, глубина проникновения в конфокальной микроскопии ограничена поглощением энергии возбуждения по всему пути луча и рассеянием образцов как фотонов возбуждения, так и излучения.
Методы деконволюции часто обеспечивают лучшее решение для образцов с относительно низким уровнем сигналов от областей вне фокуса или для образцов с общим низким уровнем сигнала. Поскольку в методах деконволюции используются обычные широкопольные микроскопы для получения изображений, интенсивность возбуждения обычно остается низкой. Следовательно, деконволюция обычно эффективна для визуализации монослоев живых клеток. Однако важно понимать, что многие так называемые методы деконволюции являются просто нелинейными фильтрами данных, которые не генерируют количественные данные. Только истинно ограниченные итеративные методы деконволюции дают количественные данные, которые можно использовать для дальнейшего анализа. Но деконволюция, выполняемая на широкополосных флуоресцентных микроскопах, обеспечивает ограниченное проникновение в толстые образцы из-за высокого уровня сигнала от областей вне фокуса и рассеяния света. Кроме того, из-за высоких вычислительных требований, деконволюционные изображения не могут обеспечить немедленную обратную связь во время эксперимента.
Двухфотонное возбуждение, как обсуждается далее в этой статье, обеспечивает трехмерное оптическое сечение без поглощения (которое привело бы к фотообесцвечиванию и фототоксичности) выше и ниже плоскости фокуса. Следовательно, этот метод обеспечивает более глубокое проникновение по сравнению с конфокальной микроскопией и может быть менее фототоксичным для живых образцов. Таким образом, двухфотонная микроскопия больше всего подходит для экспериментов, которые требуют глубокого проникновения в живые ткани или интактные образцы животных. Однако, поскольку фотофизика, управляющая двухфотонным возбуждением, отличается от таковой при обычном возбуждении флуоресценции, иногда наблюдается отрицательное воздействие при двухфотонном возбуждении определенных флуорофоров, что, в свою очередь, ограничивает применимость этого метода для оптического среза в тонких образцах.
Принцип двухфотонного возбуждения
Двухфотонное возбуждение является относительно старой теоретической концепцией в квантовой оптике. Впервые она была предложена Марией Гёпперт-Майер в своей докторской диссертации и экспериментально наблюдался примерно тридцать лет спустя, вскоре после изобретения лазера. Следовательно, существует понятное теоретическое и экспериментальное обоснование. Явление двухфотонного возбуждения возникает из-за одновременного поглощения двух фотонов в одном квантованном событии. Поскольку энергия фотона обратно пропорциональна его длине волны, два поглощенных фотона должны иметь длину волны примерно вдвое больше, чем требуется для возбуждения одного фотона. Например, флуорофор, который обычно поглощает ультрафиолетовый свет (длина волны приблизительно 350 нанометров), может также возбуждаться двумя фотонами инфракрасного света (длина волны приблизительно 700 нанометров), если оба они одновременно достигают флуорофора (см. рис. 1). В этом случае «одновременно» означает в интервале около 10 × E (-18) секунд.
Поскольку двухфотонное возбуждение зависит от одновременного поглощения, генерируемое флуоресцентное излучение изменяется как функция квадрата интенсивности возбуждения. Эта квадратичная связь между возбуждением и генерируемым излучением дает множество значительных преимуществ, связанных с двухфотонной микроскопией (более подробно обсуждается ниже). Чтобы произвести значительное количество событий двухфотонного поглощения (в которых оба фотона взаимодействуют с флуорофором одновременно), плотность фотонов должна быть примерно в миллион раз больше, чем требуется для генерации такого же количества однофотонных поглощений. Следствием этого является то, что для генерации значительной интенсивности флуоресценции при двухфотонном возбуждении требуется чрезвычайно высокая мощность лазера. Этот уровень мощности легко достигается путем фокусировки лазеров с синхронизацией мод (импульсных), в которых мощность во время пика импульса достаточно высока для данного процесса, в то время как средняя мощность лазера остается довольно низкой. В этой ситуации результирующее двухфотонно-возбужденное состояние, из которого происходит излучение, является тем же синглетным состоянием, которое заполняется при проведении обычного эксперимента. Таким образом, флуоресцентное излучение после двухфотонного возбуждения точно такое же, как излучение, генерируемое при нормальном однофотонном возбуждении. На рис. 1 представлена диаграмма Яблонского, иллюстрирующая поглощение одного (ультрафиолетового) фотона (рис. 1 (а)) и одновременное поглощение двух инфракрасных фотонов (рис. 1 (б)), создающих идентичное возбужденное состояние.
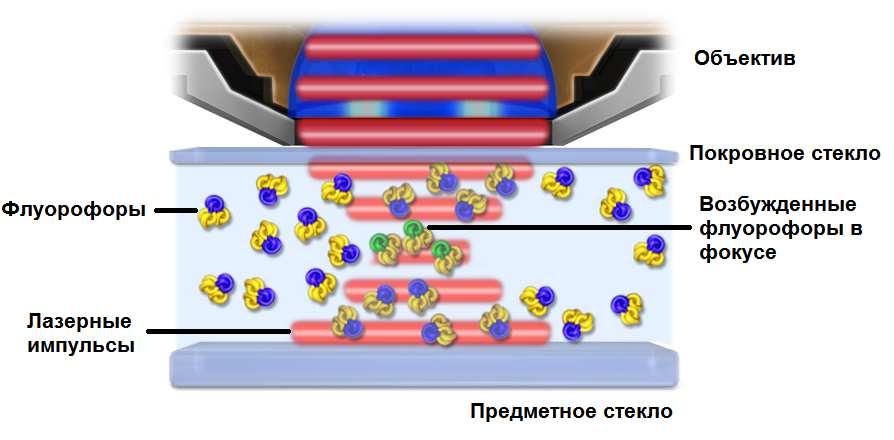
Рис.2 Возбуждение флуорофоров в мультифотонной микроскопии
Другой тесно связанный нелинейный оптический процесс, трехфотонное возбуждение, также может оказаться полезным для биологических экспериментов. Трехфотонное возбуждение происходит во многом так же, как двухфотонный процесс, за исключением того, что три фотона должны взаимодействовать с флуорофором одновременно, чтобы произвести генерацию излучения образцом. Благодаря квантово-механическим свойствам, плотность фотонов, необходимая для трехфотонного возбуждения, только примерно в десять раз превышает плотность, необходимую для двухфотонного поглощения (а не еще в миллион раз больше). Поэтому трехфотонное возбуждение можно считать привлекательным вариантом для некоторых экспериментов. Например, инфракрасный лазер (длиной волны около 1050 нм) может производить трехфотонное возбуждение поглощающего ультрафиолет флуорофора (при 350 нм) и одновременно вызывать двухфотонное возбуждение зеленопоглощающего флуорофора (при 525 нм). Кроме того, трехфотонное возбуждение может использоваться для расширения области полезной визуализации до глубокого ультрафиолета (например, использование 720 нм света для возбуждения флуорофора, который обычно поглощает ультрафиолетовое излучение при 240 нм). Это является ценным улучшением возможностей обычного микроскопа, поскольку ультрафиолетовые волны ниже примерно 300 нанометров очень проблематичны для оптики обычного микроскопа. Нелинейные эффекты высшего порядка, такие как четырехфотонное поглощение, были экспериментально продемонстрированы, хотя маловероятно, что эти явления найдут какое-либо непосредственное применение в биологических исследованиях.
Двухфотонное возбуждение в лазерной сканирующей микроскопии
Значительные преимущества использования двухфотонного возбуждения в лазерной сканирующей микроскопии вытекают из основного физического принципа, согласно которому поглощение зависит от квадрата интенсивности возбуждения. На практике двухфотонное возбуждение генерируется путем фокусировки одиночного импульсного лазера через оптику микроскопа. По мере фокусировки лазерного луча фотоны становятся ближе (их пространственная плотность увеличивается), и вероятность того, что два из них взаимодействуют одновременно с одним флуорофором, возрастает. Лазерная фокусная точка - единственное место на оптическом пути, где фотонов достаточно много, чтобы вызвать значительное двухфотонное возбуждение. Рисунок 2 схематически иллюстрирует генерацию двухфотонного возбуждения в флуорофорсодержащем образце в фокусе микроскопа. Выше фокальной точки плотность фотонов недостаточно высока для того, чтобы два фотона проходили в поперечном сечении поглощения одного флуорофора в один и тот же момент. Однако в фокусе фотоны расположены так близко, что можно найти два из них в поперечном сечении поглощения одного флуорофора одновременно.
На практике двухфотонная микроскопия становится возможной не только благодаря пространственной концентрировании фотонов (путем фокусировки оптикой микроскопа), но и благодаря их концентрирования во времени (путем использования импульсов от лазера с синхронизацией мод). Комбинированный эффект позволяет генерировать необходимые интенсивности фотонов для двухфотонного возбуждения, но рабочий цикл импульса (длительность импульса, деленная на время между импульсами) 10 × E (-5) ограничивает среднюю входную мощность до менее 10 милливатт, что чуть больше, чем в конфокальной микроскопии. Хотя длительность лазерного импульса считается сверхкороткой, обычно она составляет от 100 фемтосекунд до 1 пикосекунды (от 10 × E (-13) до 10 × E (-12) секунд), но по сравнению с событием поглощения флуорофором фотона, равным примерно 10 × E (-18) секунды, это относительно длительное событие.
Узкая локализация двухфотонного возбуждения в фокусе освещения является основой для наиболее значительных преимуществ метода перед конфокальной микроскопией. В конфокальном микроскопе, хотя флуоресценция возбуждается по всему освещенному объему, через конфокальную точечную диафрагму проходит только сигнал, исходящий из фокальной плоскости, что позволяет собирать данные без фона. Напротив, двухфотонное возбуждение генерирует флуоресценцию только в фокальной плоскости, и поскольку фоновая флуоресценция не создается, пинхол не требуется. Это резкое различие между областями возбуждения конфокальной и двухфотонной микроскопии может быть продемонстрировано путем визуализации картины фотообесцвечивания каждого метода. Рисунок 3 иллюстрирует картину фотообесцвечивания, которая возникает в направлении x-z при многократном сканировании одной плоскости x-y (плоскости изображения) в окрашенной флуорофором формваровой плёнке. Лазер конфокальной системы возбуждает флуорофоры выше и ниже фокальной плоскости (показано белой рамкой на рисунке 3 (а)), способствуя обесцвечиванию, наблюдаемому в этих обширных областях. Напротив, двухфотонное возбуждение происходит только в фокальной плоскости, и поэтому обесцвечивание ограничивается этой областью (рис. 3 (б)).
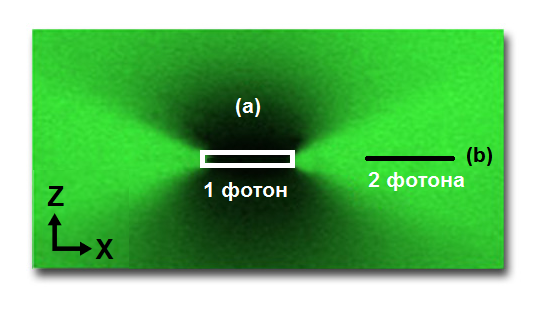
Рис.3 Одно- и двухфотонное возбуждение
Многие полезные эффекты являются результатом локализации возбуждения в методе двухфотонной микроскопии. Возможно, наиболее важным является то, что трехмерное разрешение двухфотонного микроскопа идентично тому, которое достигается в идеальном конфокальном микроскопе. Кроме того, поскольку в областях образца вне фокуса нет поглощения, большая часть возбуждающего света проникает через образец в плоскость фокуса. В результате значительно увеличивается проникновение в образец, которое обычно в два или три раза больше, чем это возможно при конфокальной микроскопии. Другим преимуществом использования двухфотонного возбуждения (показано на рисунке 3) является минимизация фотообесцвечивания и фотоповреждений - двух наиболее серьезных ограничений флуоресцентной микроскопии живых клеток и тканей. Хотя повреждение клеток, вызванное взаимодействием со светом, плохо изучено, ясно, что уменьшение фотоповреждения приведет к увеличению жизнеспособности исследуемых биологических образцов. Практический опыт свидетельствует о том, что один только красный возбуждающий свет не влияет на жизнеспособность клеток, и вполне вероятно, что большая часть наблюдаемого фотоповреждения связана с двухфотонным поглощением и, следовательно, ограничена фокальной плоскостью.
Микроскопия двухфотонного возбуждения не требует точечного отверстия для получения трехмерного разрешения, что обеспечивает гибкость в геометрии пути детектирования. Геометрия как с внутренним (descanned), так и с внешним (non-descanned) детектором представлена на рисунке 4. В геометрии с внутренним детектором излучаемый образцом свет (показанный синим цветом) возвращается по тому же пути, что и свет возбуждения, попадая на сканирующие зеркала перед прохождением через конфокальное отверстие для детектора (рис. 4 (а)). В конфокальной микроскопии эта геометрия должна использоваться для устранения детектирования излучения от областей вне фокуса.
Траектория луча в конструкции с внешним детектором предоставляет больше альтернатив конфигурации:
1) Рис. 4 (b): Детектор расположен в плоскости, сопряженной с задней апертурой объектива. Дихроичные зеркало расположено сразу после линзы объектива и отражает испускаемый свет через передающую линзу на детектор.
2) Рис. 4 (c): Излучаемый свет может регистрироваться внешним детектором непосредственно от образца, не проходя через линзу объектива.
3) Рис. 4 (d): или испускаемый свет отклоняется дихроичным отражателем на прибор с зарядовой связью (ПЗС камера) в промежуточной плоскости изображения, чтобы получить широкопольное изображение.
Эта последняя конфигурация подходит для систем быстрого сбора данных, использующих двухфотонное возбуждение.
Хотя для двухфотонного возбуждения можно использовать детектирование с внутренним детектором, для того, чтобы в полной мере воспользоваться преимуществами глубокого проникновения в образец этой техники, рекомендуется использовать геометрию с внешним детектором. Оптический путь системы с внешним детектором позволяет собирать больше рассеянных фотонов, требует меньше оптических элементов, таких как зеркала и линзы, и уменьшает длину пути, по которому частицы пыли в воздухе влияют на флуоресцентный сигнал. Следовательно, использование внешнего детектора с двухфотонным возбуждением значительно повышает эффективность сбора данных и имеет важное значение для максимальной глубины проникновения в живую ткань.
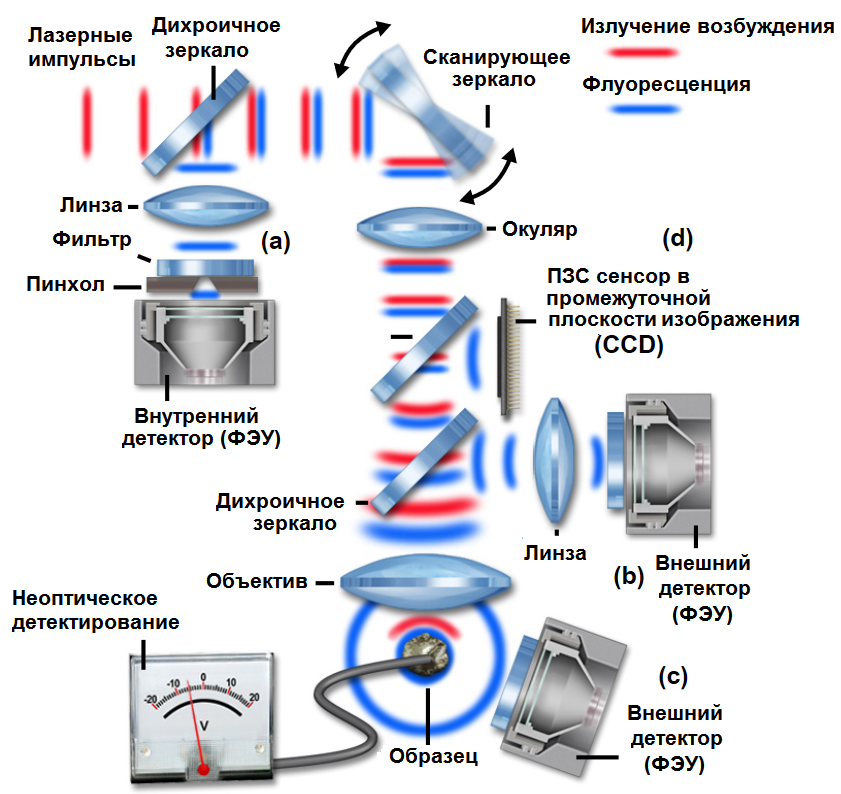
Рис.4 Разные конфигурации детектирования в мультифотонной микроскопии
Механизмы глубокого сечения
Как обсуждалось выше, наиболее мощным преимуществом двухфотонной микроскопии является ее способность обеспечивать превосходное оптическое сечение на больших глубинах в толстых образцах, чем это возможно другими методами. Поэтому важно понимать, каким образом достигается эта увеличенная глубина проникновения. Существуют три механизма, которые работают в комбинации для обеспечения повышенной эффективности при работе с толстыми образцами:
· Отсутствие поглощения света от областей образца вне фокуса позволяет большему количеству световых фотонов возбуждения достигать желаемого уровня образца;
· Красное и ИК излучение, используемое при двухфотонном возбуждении, подвергаются меньшему рассеянию, чем излучение с длинами волн ближе к синией области спектра (короткие волны);
· Эффект рассеяния света менее вреден для двухфотонной микроскопии, чем для конфокальной микроскопии.
Хотя они работают в комбинации, полезно рассмотреть три механизма по отдельности. Двухфотонный микроскоп позволяет большей доле излучения возбуждения достигать фокальной плоскости, поскольку условия для поглощения не соблюдаются за пределами области концентрации света, а расфокусированное поглощение устраняется. В конфокальном микроскопе фотоны возбуждения поглощаются любыми флуорофорами, которые встречаются вдоль пути света возбуждения. Следствием этого является то, что меньшее количество фотонов достигает фокальной плоскости, тем самым уменьшая генерируемый сигнал. Этот эффект становится более выраженным, если образец содержит флуорофоры повсюду, как показано на изображениях, представленных на рисунке 5. Образец полимерной пленки, окрашенный родамином, представленный на этом рисунке, сам по себе не рассеивает свет, но содержит равномерное распределение высокой концентрации флуорофора.
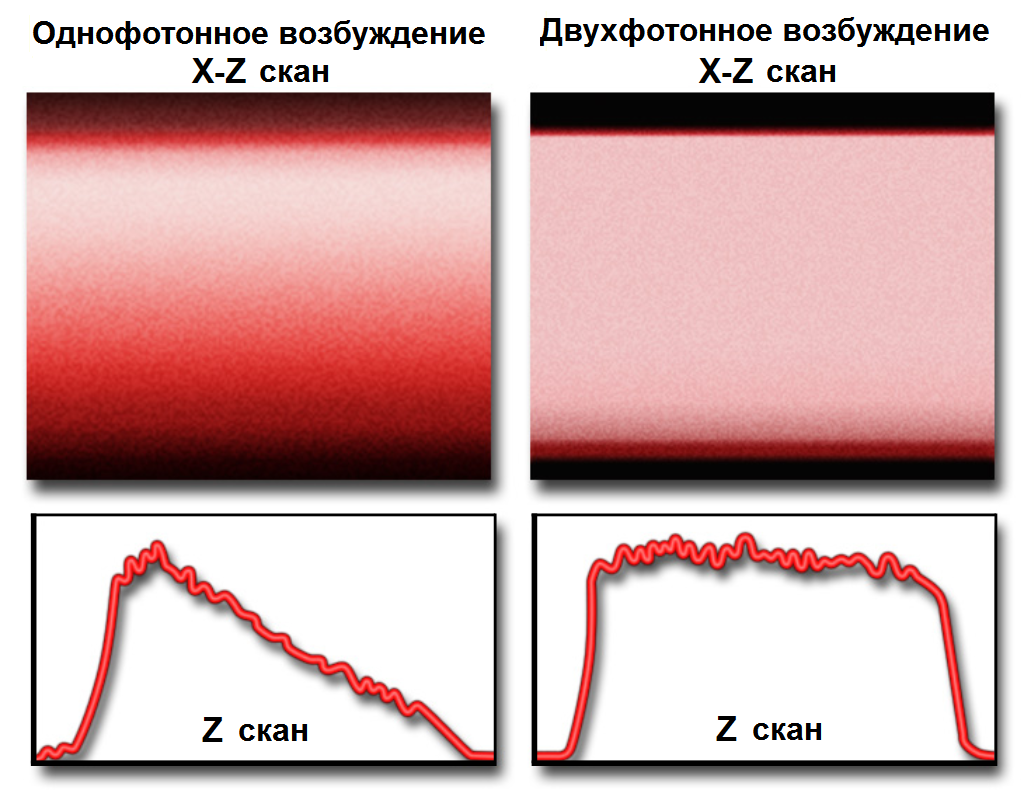
Рис.5 Одно- и двухфотонное возбуждение
Верхняя часть рисунка 5 - x-z-сканы. Интенсивность флуоресценции изображается как функция глубины проникновения в образец (расстояние z) для каждого x-z-скана. Для однофотонного механизма возбуждения (конфокальная микроскопия, рис. 5 (а)) интенсивность демонстрирует устойчивое уменьшение при увеличении глубины проникновения, поскольку свет возбуждения все больше поглощается по мере того, как он достигает более глубоких фокальных плоскостей. В отличие от этого, двухфотонное поглощение происходит только в фокальной плоскости без поглощения света возбуждения флуорофорами на оптическом пути между линзой объектива и фокальной плоскостью. Таким образом, вся энергия возбуждения достигает фокальной плоскости, которая поддерживает сигнал флуоресценции постоянным по всей глубине образца (полимер в этом примере). Рисунок 5 (b) иллюстрирует существенную разницу между конфокальным и двухфотонным возбуждением, при котором интенсивность относительно постоянна с глубиной проникновения.
Второй механизм, способствующий более высокой эффективности двухфотонного возбуждения в толстых образцах, состоит в том, что "красный" свет возбуждения, используемый в двухфотонной микроскопии, испытывает меньшее рассеяние на образце, чем "более синий" свет возбуждения, используемый при обычном возбуждении. Биологическая ткань может рассматриваться как неоднородная среда, имеющая переменный показатель преломления. Свет, распространяющийся через такую среду, многократно рассеивается в различных направлениях. В флуоресцентной микроскопии возбуждающий свет, падающий на образец, может рассеиваться в различной степени, прежде чем он достигнет фокальной плоскости, и результирующая флуоресценция может также подвергаться рассеиванию, когда она возвращается через образец к детектору. Оба этих рассеивающих эффекта объединяются, ослабляя регистрируемый сигнал флуоресценции.
Из-за нерегулярного распределения материала, имеющего переменные свойства в биологических образцах, невозможно рассчитать или точно моделировать поведение рассеяния. Однако простейшее приближение рэлеевского рассеяния дает минимальную оценку доли света, рассеянного в такой системе. В этом случае количество рассеянного света обратно пропорционально четвертой степени длины волны света. Используя это соотношение при оценке, можно ожидать, что 488 нм (однофотонное возбуждение) будет подвергаться примерно в семь раз большему рассеянию, чем 800 нм (двухфотонное возбуждение). Таким образом, это различие в рассеянии вносит дополнительный вклад в количество лазерного излучения при двухфотонном возбуждении, которое может достигать фокальной плоскости, и дополнительно увеличивает глубину проникновения в образец. На практике наблюдаемое рассеяние от взаимодействия с тканевыми структурами всегда больше, чем предсказывает приближение Рэлея, но более длинные (более красные) длины волн неизменно рассеиваются меньше, чем более короткие (более синие) длины волн. На этапе детектирования испускаемая флуоресценция одинакова независимо от того, была ли она сгенерирована с использованием одно- или двухфотонного возбуждения, и, следовательно, рассеяние флуоресцентного излучения одинаково влияет на оба метода.
Третий фактор, перечисленный выше, заключается в том, что любое рассеяние света возбуждения или флуоресценции не влияет на сбор сигналов в двухфотонных методах так же существенно, как в конфокальной микроскопии. Эта разница может быть объяснена при рассмотрении физики формирования изображения в двухфотонной микроскопии. В то время как отсутствие регистрации излучения от областей вне фокуса и различия в рассеянии способствуют увеличению света возбуждения, достигающего фокальной плоскости глубоко внутри неповрежденной ткани, этот третий фактор фактически создает повышенный контраст изображения при двухфотонном возбуждении. Физические аспекты, способствующие этому, показаны на рисунке 6.
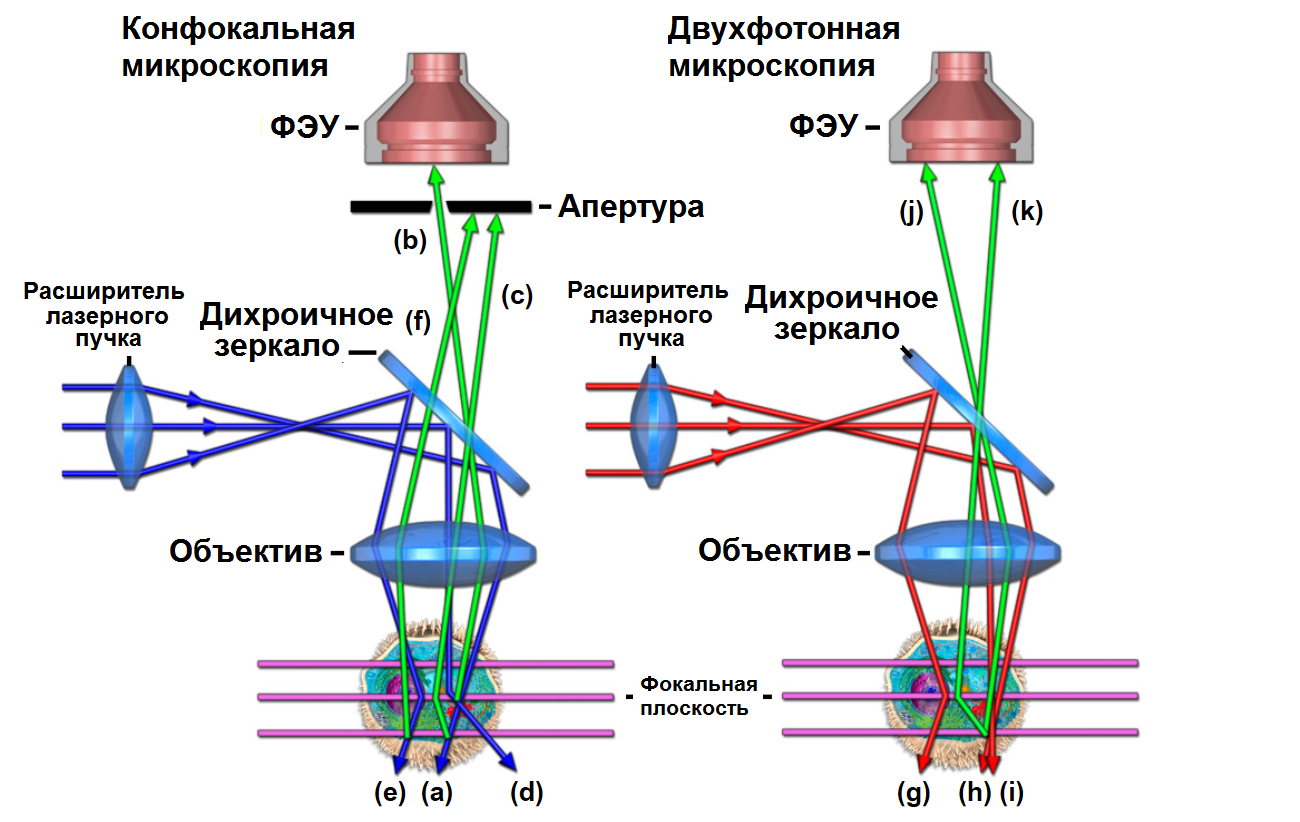
Рис. 6 Конфигурация оптического пути конфокального и мультифотонного микроскопов
В конфокальном микроскопе (см. рис. 6) свет возбуждения (синий) фокусируется на образце (а), а флуоресценция (зеленая) от этого фокального пятна захватывается линзой объектива, проходит через сквозное отверстие, и достигает детектора (б). Этот флуоресцентный свет является желаемым сигналом, но некоторая его часть может рассеиваться при прохождении через образец (с). Эта рассеянная флуоресценция не проходит через отверстие, и поэтому теряется и не детектируется. Эти потери значительно уменьшают регистрируемый сигнал флуоресценции. Когда свет возбуждения проходит через образец, он может поглощаться (d) или рассеиваться до того, как достигнет фокуса (e). Если свет поглощен, это может произвести флуоресценцию. Так как эта флуоресценция возникает не из фокального пятна, она не проходит через отверстие, поэтому она не детектируется эффективно. Тем не менее, небольшая часть флуоресценции от областей вне фокуса может быть рассеяна в область апертуры, а затем зарегистрирована. Эта флуоресценция создаст фоновый шум, который будет примерно постоянным по всему изображению, как показано в примерах на рисунках 7 и 8. Этот шум уменьшает динамический диапазон изображения, тем самым уменьшая контраст изображения. Аналогично, рассеянное возбуждение может генерировать флуоресценцию (е), и эта флуоресценция также может вносить вклад в фоновый шум (f).
В двухфотонном методе возбуждения (см. рисунок 6) фотоны возбуждения (красные) могут рассеиваться (g), как в конфокальной системе. Однако вероятность одновременного рассеяния двух фотонов в одном и том же месте образца практически равна нулю, и, следовательно, при двухфотонном возбуждении фоновый шум, вызывающий ухудшение конфокального изображения в толстых образцах, не создается. Кроме того, большая часть света возбуждения достигает фокальной плоскости (h и i) из-за первых двух факторов, рассмотренных выше: уменьшенное поглощение в областях вне фокуса и уменьшенное рассеяние длинноволнового излучения возбуждения. Важно отметить, что генерируемая флуоресценция (зеленая), даже если она рассеивается, имеет повышенную вероятность детектирования с помощью ФЭУ (j), потому что отсутствует апертура для ее блокирования (k). Эта нечувствительность к эффектам рассеяния и отсутствие поглощения излучения в областях вне фокуса позволяют сохранить полный контраст изображения со значительной глубиной проникновения в образец.
Изображения, представленные на рис. 7 (сосудистое спрлетение акулы, окрашенное флуоресцирующим веществом), обеспечивают сравнение качества изображения, полученного при конфокальной и двухфотонной микроскопии. Эти изображения были собраны на 80 микрометров ниже поверхности образца, что является максимальной глубиной, позволяющей получить достаточный контраст изображения от этого образца с использованием конфокальной микроскопии. Хотя уровень сигнала самых ярких объектов можно легко согласовать между двумя методами, общая контрастность изображения в конфокальном изображении (рис. 7 (а)) значительно снижается из-за наличия фонового шума. Для сравнения, двухфотонное изображение (рис. 7 (б)) демонстрирует превосходный контраст. Поскольку рассеяние флуоресценции является значительным в толстых биологических образцах, использование внутреннего детектирования, даже с «открытой» апертурой, недостаточно для получения преимуществ двухфотонного возбуждения.

Рис.7 Качество изображения в конфокальной и многофотонной микроскопии
Чтобы полностью реализовать потенциал, для повышения эффективности сбора флуоресценции требуется схема детектирования с внешним детектором (см. Рисунок 4), в которой флуоресценция не возвращается через сканирующую систему, как это должно быть в конфокальном микроскопе. С использованием того же образца акулы, показанного на рисунке 7, на рисунке 8 представлено сравнение изображений, использующих методы детектирования с внутренним ("открытый" пинхол) и внешним детектором. При каждой геометрии детектирования использовались одни и те же оптические компоненты для формирования изображения, включая дихроичное зеркало, фильтр и фотоумножитель. Первоначально образец был визуализирован с использованием внутреннего детектирования на глубине (140 микрометров) вблизи максимума, что обеспечивало некоторый контраст интенсивности (рис. 8 (а)). Сохраняя все настройки фиксированными и переключаясь на внешнее сканирование, было зарегистрирвоано изображение, представленное на рисунке 8 (b). Здесь использовалось внешнее детектирование, изображение полностью насыщено (максимальная яркость) во многих областях, демонстрируя улучшенный сбор сигнала с этой геометрией детектирования. Поскольку условия возбуждения были идентичны в обоих случаях, это восьмикратное увеличение интенсивности сигнала можно объяснить исключительно сбором рассеянных фотонов флуоресценции, что обеспечивается геометрией с внешним детектором. Чтобы получить ненасыщенное изображение с полным диапазоном (показано на рисунке 8 (с)), напряжение трубки фотоумножителя было уменьшено с 1000 до 750 вольт, что означает, что этот образец можно сканировать еще глубже, используя внешний детектор. Фактически, глубина проникновения для приемлемой визуализации в этом образце была не ограничена тканью, но рабочим расстоянием объектива.

Рис. 8 - Методы детектирования с внешним и внутренним детектором
Разрешение изображения
Разрешение изображения, полученное при двухфотонном возбуждении, не лучше, чем при хорошо отъюстированном конфокальном микроскопе. Использование более длинных волн возбуждения (таких как красные или инфракрасные, вместо ультрафиолетовых или синих), хотя и является предпочтительным аспектом двухфотонного возбуждения, фактически приводит к большему разрешающему пятну. Если биологическая структура не может быть разрешена в конфокальном микроскопе, она также не будет разрешена в лазерном сканирующем микроскопе с двухфотонным возбуждением. Хотя этот момент хорошо понимают микроскописты, имеющие опыт работы с этими методами, потенциальные пользователи в сообществе биомедицинских исследований часто предполагают, что преимущества двухфотонного возбуждения включают повышенное разрешение.
Визуализация толстых образцов
Как обсуждалось ранее, двухфотонное возбуждение более эффективно для визуализации толстых образцов благодаря комбинированному эффекту трех факторов: отсутствие поглощения в областях образца вне фокуса позволяет большему количеству света возбуждения достигать нужной области образца; красный возбуждающий свет рассеивается меньше; и эффекты флуоресцентного рассеяния менее вредны для двухфотонной микроскопии, чем для конфокальной микроскопии. Когда используется оптика с большим рабочим расстоянием и конфигурация детектирования с внешним детектором, глубина проникновения и качество изображения часто ограничиваются способностью эффективно окрасить ткань. Введение флуоресцентных меток в ткани становится все труднее на больших глубинах. Эксперименты, использующие преимущества экспрессии зеленого флуоресцентного белка (GFP) у трансгенных животных, вероятно, улучшают визуализацию двухфотонного возбуждения in vivo. Трансгенные животные предлагают огромные перспективы в разработке улучшенных методов флуоресцентной маркировки специфических органов и белков живых животных для обнаружения с использованием двухфотонного возбуждения. Определенные характеристики ткани могут накладывать дополнительное ограничение на глубину проникновения при визуализации толстых образцов, и особенно это касается либо сильно пигментированных тканей, таких как печень, либо сильно рассеивающих тканей, таких как кожа.
Визуализация тонких образцов
В целом, для визуализации тонких образцов не требуются преимущества двухфотонного метода возбуждения по сравнению с обычной конфокальной микроскопией. Причиной этого является слегка увеличенное фотообесцвечивание, которое может происходить в фокальной плоскости (общее фотообесцвечивание в толстом образце значительно снижается по сравнению с обычными методами, как показано на рисунке 3). Однако существуют приложения, для которых двухфотонное возбуждение выгодно даже для тонких препаратов; Одним из примеров является визуализация флуорофоров с ультрафиолетовым возбуждением, таких как NADH (дальнейшее обсуждение следует). В таких экспериментах повреждение, вызванное ультрафиолетовым светом, является более значительным, чем двухфотонное фотообесцвечивание. При оценке потенциальных преимуществ двухфотонного возбуждения всегда стоит сначала провести эксперименты на конфокальном микроскопе. Как только становится известно, какие ограничения накладываются конфокальным микроскопом для желаемого изображения, тогда легко определить, будет ли выгодным использование двухфотонного возбуждения для завершения экспериментов.
Спектр поглощения
Обычно двухфотонные спектры поглощения мало похожи на соответствующие однофотонные спектры. Опыт, полученный к настоящему времени, показывает, что большинство флуорофоров функционируют довольно хорошо, когда двухфотонное освещение возбуждения имеет удвоенную длину волны пика однофотонного поглощения флуорофора. По физико-химическим причинам, выходящим за рамки этого обсуждения, флуорофоры с несимметричной химической структурой имеют тенденцию придерживаться этого отношения более близко, чем симметричные. Например, флуоресцентные белки (CFP, GFP, YFP и другие) характеризуются несимметричным флуорофором и сильно поглощают при удвоенной длине волны однофотонного возбуждения. Однако для полного использования возможностей микроскопии с двухфотонным возбуждением необходимо измерять спектры поглощения флуорофоров. Технически это значительно сложнее, чем измерение обычных однофотонных спектров поглощения, и существует только несколько источников этой информации. Поскольку использование этого метода микроскопии возрастает, вероятно, что двухфотонные спектры поглощения станут более доступными.
Локализованная фотохимия
Дополнительной возможностью двухфотонного возбуждения является инициирование фотохимических реакций в фокальной области образца. Разнообразные экспериментально полезные химические процессы включают реакции, индуцированные ультрафиолетовым светом, для которых можно заменить двухфотонное возбуждение. Одна категория реакций - расщепление красителя, которая фотохимически индуцирует превращение нефлуоресцентной молекулы в флуоресцентную, может инициироваться в отдельных клетках ткани с использованием двухфотонного возбуждения. Точно так же биологические стимуляторы или супрессанты могут быть разряжены одним и тем же процессом возбуждения. Разнообразие потенциальных методов двухфотонно-возбужденного расцепления еще предстоит полностью разработать, в основном из-за ограничений, обусловленных кинетикой фотореакций, которая может варьироваться от миллисекунд до секунд. Таким образом, целевое соединение может диффундировать в пределах нескольких микрометров в образце между временем его возбуждения и временем, когда оно становится активным. Несмотря на эту трудность, этот метод, вероятно, будет полезен в ряде интересных биологических приложений, некоторые из которых обсуждаются в следующих разделах.
Лазерные источники
Требования к оборудованию для двухфотонной микроскопии почти идентичны требованиям для конфокальной микроскопии, за исключением требований к источнику лазерного возбуждения, которые значительно отличаются. Два типа лазерных систем с короткими импульсами и синхронизацией мод обычно используются в современных двухфотонных микроскопах: титан- сапфировый лазер и Nd:YLF лазер. Хотя эти системы могут питаться от обычных электрических розеток и не требуют водяного охлаждения, они значительно дороже, чем небольшие лазеры с воздушным охлаждением, используемые в конфокальной микроскопии. Перестраиваемость длины волны титан- сапфирового лазера (от 700 до 1100 нанометров) дает ему большую универсальность, по сравнению с одноволновым Nd:YLF-лазером (1047 нанометров). И современные коммерческие модели титан-сапфировых лазеров охватывают диапазон длин волн от 720 до 900 нанометров через легко реализуемый компьютерный контроль. Дальнейшее повышение простоты использования и универсальности систем лазерного освещения, вероятно, продолжится в обозримом будущем.
Мощность лазера
Мощность лазера, необходимая для возбуждения содержащего флуорофор образца, имеет оптимальное предельное значение. С увеличением мощности лазера интенсивность флуоресценции увеличивается до точки насыщения флуорофора. Условие насыщения возникает при мощности лазера, достаточной для того, чтобы значительная часть флуоресцентных молекул находилась в возбужденном, а не основном состоянии (этот уровень мощности составляет около 1 милливатта на образце для однофотонного возбуждения и 50 милливатт на образце для двухфотонного возбуждения). При более высоких уровнях мощности дополнительные фотоны просто неспособны возбуждать больше флуоресцентных молекул. Любое увеличение энергии возбуждения за пределы точки насыщения способствует увеличению фотоповреждения и фотообесцвечивания. Каждая экспериментальная установка должна быть оценена на предмет повреждения, нанесенного во время сканирования луча, и важно признать, что тривиальные тесты жизнеспособности клеток (такие как активность эстеразы или исключение красителя) не всегда точно отражают клеточное фотоповреждение. Для многих экспериментов более строгие функциональные тесты могут быть более информативными. Например, в одном недавнем опубликованном исследовании жизнеспособность эмбрионов хомяка была подтверждена их постоянным развитием, а в другом жизнеспособность островков поджелудочной железы была подтверждена их поддержанием нормального стимулированного глюкозой ответа NAD(P)H.
Примеры двухфотонной микроскопии
Ряд примеров недавно опубликованных экспериментальных результатов иллюстрирует типичные ситуации, в которых двухфотонное возбуждение обеспечивает преимущества по сравнению с конфокальной визуализацией. Хотя подробности экспериментов не приводятся в этом обсуждении, основные моменты сосредоточены на преимуществах двухфотонного возбуждения, обусловленных его пониженной фототоксичностью, увеличенной глубиной визуализации ткани и способностью инициировать фотохимические процессы.
Микроскопия двухфотонного возбуждения, как правило, менее фототоксична, чем конфокальная микроскопия, что продемонстрировано недавним исследованием, использующим замедленную визуализацию развития эмбрионов хомяка. В этом примере развитие эмбрионов можно было контролировать непрерывно в течение более 10 часов с помощью двухфотонного возбуждения митохондриального красителя. Для сравнения, когда применялись конфокальные методы, нормальное развитие эмбриона прекращалось после нескольких минут конфокального лазерного воздействия. Исследователи пришли к выводу, что большая длина волны двухфотонного лазера с возбуждением (1047 нм) позволяет значительно увеличить время жизнеспособности эмбрионов. Те же исследователи также использовали двухфотонную микроскопию, чтобы оценить влияние неорганического фосфата на развитие эмбрионов хомяка. В этом эксперименте живые эмбрионы хомяка культивировали в различных количествах неорганического фосфата, и их распределение в митохондриях отображали на 6 часах культивирования с использованием двухфотонной микроскопии. После дальнейшего развития эмбриона морфологическую оценку проводили через 27 и 51 час культивирования. Из этих исследований были получены четкие доказательства того, что двухфотонное освещение не мешало развитию эмбрионов хомяка, в то время как они были повреждены параллельной конфокальной визуализацией.
В двух опубликованных исследованиях использовалась нетоксичная природа двухфотонного возбуждения для визуализации кожи человека in vivo. Одно исследование включало детальную спектроскопию сигналов автофлуоресценции, собранных с кожи на различных глубинах (от 0 до 50 и от 100 до 150 микрометров), с использованием длин волн возбуждения в диапазоне от 730 до 960 нанометров. При использовании в сочетании с конфокальной микроскопией отраженного света комбинация методов обеспечивает детальные изображения отраженного света и автофлуоресценции слоев кожи из одной и той же области кожи без повреждения.
Двухфотонное возбуждение обеспечивает возможность избежать фототоксических эффектов ультрафиолетового излучения для флуоресцентных частиц, которые активируются в этом спектральном диапазоне. Эта особенность особенно полезна для визуализации природных редуцированных пиридиновых нуклеотидов [NAD (P) H] в качестве индикатора клеточного дыхания. Поскольку NAD (P) H имеет малое поперечное сечение поглощения, низкий квантовый выход и поглощает ультрафиолет, его трудно возбуждать и измерять, и он может вызвать значительное фотоповреждение. Визуализация NAD(P)H была использована для изучения патофизиологии культивируемых частично дифференцированных клеток миотрубок L6. Аутофлуоресцентная картина, проявляемая на клеточных NAD(P)H изображениях, в первую очередь отражает NADH в митохондриях в виде точечных областей над диффузным цитоплазматическим сигналом. В дифференцированных клетках флуоресценция проявляется в виде столбцов митохондрий, локализованных между полосами мышечных волокон, и увеличение флуоресценции сопровождается увеличением концентрации глюкозы. Это исследование продемонстрировало гомогенность метаболизма глюкозы и то, что кинетика использования глюкозы может быть определена в режиме реального времени для одной клетки или может быть усреднена по нескольким клеткам.
Дополнительной областью исследований, о которой сообщалось в литературе, является количественная двухфотонная визуализация NAD(P)H, сосредоточенная на отдельных бета-клетках внутри островка поджелудочной железы, который представляет собой квазисферический микроорганизм, состоящий из около 1000 клеток. Расширяя общую визуализацию нуклеотидов, пространственное разрешение двухфотонной техники позволяет разделять цитоплазматические и митохондриальные сигналы NAD(P)H. На рис. 9 представлено типичное изображение аутофлуоресценции бета-клеток NAD(P)H внутри неповрежденного островка, на котором отображаются сигналы как из цитоплазмы, так и из митохондрий, причем последний более яркий и несколько пунктированный. Видны очертания отдельных клеток, а также ядра, оба из которых кажутся темными. Благодаря разделению цитоплазматических и митохондриальных сигналов в этих областях панкреатических островковых бета-клеток становится возможным детальное изучение метаболизма глюкозы и пирувата.
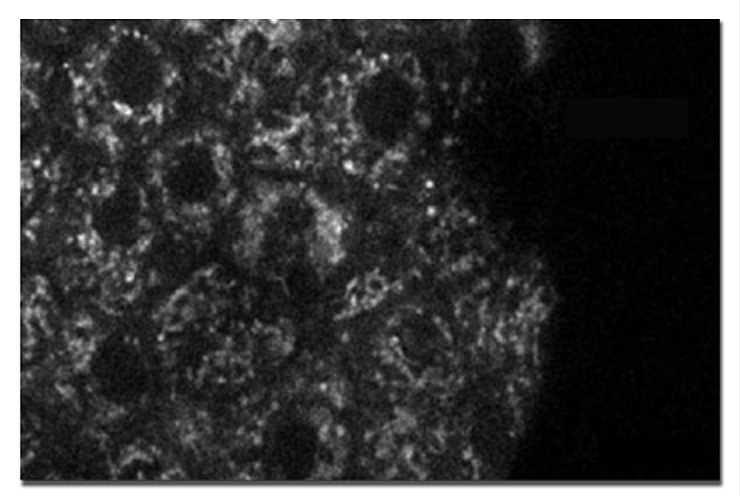
Рис. 9 Бета-клетка панкреатического островка NAD(P)H, автофлуоресценция
Современные модели для стимулированной глюкозой секреции инсулина (GSIS) предполагают, что метаболиты, расположенные дальше по пути передачи сигнала, должны стимулировать сходный каскад событий передачи сигналов и приводить к секреции инсулина, хотя пируват усиливает GSIS, но не вызывает секрецию инсулина самостоятельно. В исследовании упоминается использование двухфотонной визуализации NAD(P)H и разделения цитоплазматических и митохондриальных сигналов, чтобы продемонстрировать, что бета-клетки метаболизируют пируват, хотя и временно. Такой временный митохондриальный ответ предполагает две отдельные модели, которые в настоящее время изучаются: либо митохондриально-пируватный транспорт, либо трикарбоксильный цикл ингибируется во время позднего метаболизма пирувата. Используя методы двухфотонного возбуждения, живые островки поджелудочной железы периодически сканировали для получения данных с интервалами отбора проб, которые не могут быть получены биохимическими методами. Повторная визуализация этого типа просто не может быть выполнена с использованием конфокальной микроскопии из-за ограничений, налагаемых фотообесцвечиванием и фотоповреждением, вызванным ультрафиолетовым светом.
Поскольку в двухфотонной микроскопии используются лазеры с синхронизацией мод (импульсные), ее можно легко расширить в сочетании с флуоресцентным отображением времени жизни. Изображения, основанные на наносекундном времени затухания флуоресценции, предоставляют информацию, которая не зависит от концентрации флуорофора. Одним из возможных применений является использование визуализации времени жизни флуоресценции для получения однозначного значения эффективности передачи энергии флуоресцентного резонанса (FRET) между двумя зондами. В недавнем исследовании для количественного определения концентрации NAD(P)H в различных субклеточных компартментах использовалась двухфотонная микроскопия NAD(P)H в течение всей жизни. Уровни свободного NADH в ядре регулируют корепрессор CtBP, который является участником регуляции клеточного цикла и транскрипционных путей трансформации. Посредством совместного использования двухфотонной микроскопии NAD(P)H и визуализации в течение жизни было продемонстрировано, что уровни свободного NADH в ядре близко соответствуют полумаксимальной концентрации для связывания CtBP.
Техника двухфотонного возбуждения может сочетаться с широким спектром других известных биофизических методов, включая флуоресцентную корреляционную спектроскопию (FCS) и восстановление флуоресценции после фотообесцвечивания (FRAP). Каждый из этих методов обычно использует стационарные (непрерывные) лазеры. Метод FCS определяет число заполнения и диффузионные характеристики флуоресцентных зондов в фокусном объеме стационарного освещающего пучка и был успешно применен в исследованиях молекулярного взаимодействия и диффузии. С помощью управляемого фотообесцвечивания флуоресценции в фокальной области лазера с последующим наблюдением восстановления флуоресценции FRAP использовался для изучения макроскопической диффузии флуоресцентных молекул. Методы FCS и FRAP широко использовались для исследования диффузионных характеристик флуоресцентных зондов на культивируемых клеточных мембранах. На сегодняшний день сложность этих методов ограничивает их применение в системах in vitro и моделях клеточных культур. Когда количественные данные требуются от любого метода, четко определенный объем возбуждения в двухфотонной микроскопии возбуждения является преимуществом. Кроме того, можно ожидать, что FCS и FRAP будут очень ценными при изучении бимолекулярной динамики в толстых живых тканях, используя двухфотонное, а не однофотонное возбуждение.
Глубокое проникновение в образец, достижимое при двухфотонном возбуждении, позволяет получать изображения in vivo, хотя при визуализации живых животных необходимо решить ряд проблем. In vivo флуоресцентное изображение может быть получено путем двухфотонного возбуждения через хирургические отверстия в коже живого животного или через «окна» покровного стекла, помещенные на животное. Дополнительным осложнением при работе с живыми животными является значительная трудность флуоресцентной маркировки образца. В одном опубликованном исследовании сообщается об использовании индикатора Ca2 + для специфической маркировки нейронов у живых мышей, что позволяет осуществлять мониторинг нейронной функции с использованием методов двухфотонного возбуждения. Экспрессия зеленого флуоресцентного белка (GFP) у трансгенных животных для флуоресцентной метки специфических органов и белков, несомненно, приведет к дополнительным применениям двухфотонного возбуждения для визуализации in vivo. Из-за вероятности того, что живые образцы будут перемещаться во время процесса визуализации, большинство исследований in vivo в настоящее время проводятся с анестезированными животными, и скорость визуализации увеличивается, чтобы ограничить эффект этого движения. Вполне вероятно, что будущие технологические достижения, такие как миниатюризация двухфотонных микроскопов для прикрепления непосредственно к живому образцу, позволят получать изображения in vivo свободно движущихся животных.
Потенциально очень мощное применение микроскопии с двухфотонным возбуждением - это трехмерное разрешение фотовысвобождения соединений в клетке, называемое uncaging.
Заключение
Микроскопия с двухфотонным возбуждением предлагает много преимуществ для динамической визуализации живых клеток в толстых образцах, таких как неповрежденная ткань. Данный метод делает возможным множество экспериментов, в которых обычные изображения не могут быть получены, или не будет предоставлять желаемую информацию. Благодаря импульсному лазерному излучению с синхронизацией мод для получения достаточной плотности фотонов в фокальной точке, двухфотонное возбуждение происходит только в фокальной плоскости. Преимущество локализованного возбуждения состоит в том, что излучение ограничено узкой фокальной областью, обеспечивая способность к регистрации срезов без использования точечного отверстия. Кроме того, ограниченная область возбуждения уменьшает фототоксичность, потому что фотоповреждение в значительной степени ограничено объемом образца в фокусе.
Хотя двухфотонная микроскопия не дает изображений с более высоким разрешением, чем конфокальная микроскопия, она позволяет увеличить глубину проникновения в толстые образцы. Большая глубина проникновения возможна отчасти из-за геометрии двухфотонного микроскопа, отсутствия расфокусированного поглощения света возбуждения и уменьшенного рассеяния света возбуждения (из-за его длины волны). Для того, чтобы в полной мере воспользоваться глубиной проникновения, необходимо использовать геометрию с внешним детектором, что приводит к значительному увеличению эффективности сбора рассеянных флуоресцентных фотонов. Преимущества двухфотонного возбуждения четко установлены и позволяют проводить эксперименты, которые были бы невозможны при использовании конфокальной микроскопии.







