Это один из самых важных вопросов нейробиологии, и исследователи занимались им на протяжении десятилетий: как паттерны срабатывания в определенных нейронных цепях определяют поведение животного? Ранние исследования вырезанных срезов мозга лишь намекали на ответ, позволяя нам лишь предполагать, как паттерны возбуждения отдельных нейронов могут меняться во время активности.
Чтобы лучше ответить на этот вопрос, Бернд Кун решил визуализировать нейронные импульсы в мозгу животного, когда оно реагирует на раздражители или выполняет различные действия. Это потребовало от Куна, эксперта по нейровизуализации из аспирантуры Окинавского института науки и технологий в Японии, расширить возможности метода визуализации, называемого многофотонной микроскопией.
С момента своего появления в 1990-х годах многофотонная микроскопия помогла выявить клеточные изменения во время развития мозга или нейродегенеративные заболевания на животных моделях. По мере своего совершенствования, данный метод визуализации открыл окно в работу коры головного мозга — самого внешнего слоя мозга, — который отвечает за множество важнейших и высших функций.
Чтобы помочь нейробиологам выяснить, что не так в мышиных моделях болезней Альцгеймера, Паркинсона и других заболеваний головного мозга, Кун поставил перед собой сложную задачу: создать фундамент знаний о том, как мозг интегрирует сенсорную, двигательную и когнитивную информацию, когда мыши выполняют разнообразные действия. Это означало наблюдение за глубоким, ранее недоступным слоем зрительной коры, который сообщается с еще более глубоким слоем мозга, называемым таламусом, и делать это более часа, пока каждая мышь бегает, спит или просыпается.
Недавно Куну это удалось. Когда мышь бежала по движущемуся мячу, пытаясь достичь награды в виде воды, с неподвижной головой, поведенческая камера наблюдала за ее глазами, чтобы оценить настороженность, а также измеряла, как часто она облизывала свои усы и другие параметры. Затем Кун сопоставил это поведение с нейронной активностью в ходе более чем двухчасовых наблюдений — достаточного времени, чтобы мышь утомилась и заснула, сообщили он и его коллеги в журнале Current Biology в октябре. Эксперимент должен длиться так долго, чтобы наблюдать различные поведенческие реакции. утверждает Кун.
«Для нас это начало поиска связи между поведением и активностью нейронов», — говорит Кун. «Это нужно вам как основа для понимания того, что происходит не так, если у вас какое-либо заболевание нейронов.
Проникающая визуализация
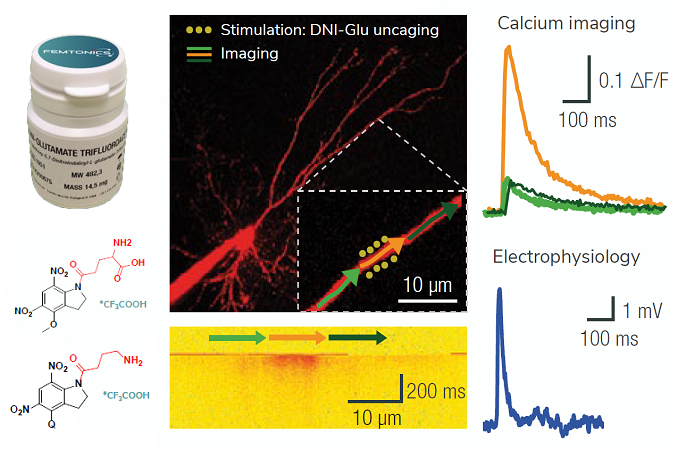
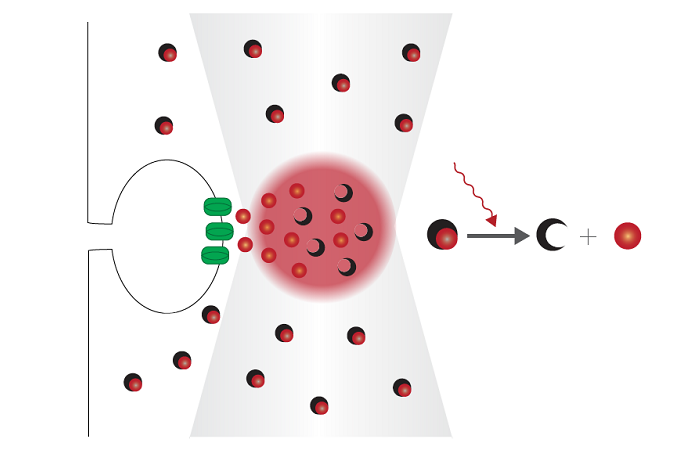
Многофотонная микроскопия решила давнюю проблему биологической микроскопии. Ученые часто добавляют к клеткам флуоресцентные маркеры, чтобы выделить определенные структуры. Но в конфокальной микроскопии, современном методе, видимый свет, используемый для возбуждения этих флуорофоров, может повредить ткань мозга. В начале 1990-х годов Винфрид Денк и покойный Уотт Уэбб из Корнельского университета придумали, как избежать этого ущерба, возбуждая флуорофоры инфракрасным светом вместо видимого света. Инфракрасный свет обладает меньшей энергией, поэтому для возбуждения флуорофора требуется два фотона, а не один. Но поскольку он обладает меньшей энергией, он может проникать глубже в мозг, не повреждая ткани. Это позволило нейробиологам маркировать определенные типы нейронов флуоресцентным белком или другим флуоресцентным маркером, а затем освещать скрытые нейронные цепи инфракрасным светом через прозрачное окно, расположенное в черепе животного.
Чтобы контролировать нейронные цепи и одновременно отслеживать поведение, Кун воспользовался платформой визуализации, которую он разрабатывал пять лет совместно с Sutter Instrument, компанией по производству научных приборов. Система включает в себя микроскоп с подвижным объективом Sutter (МОМ) — двухфотонный инструмент, который позволяет осуществлять пространственное сканирование, перемещая объектив в пространстве и используя лазеры для освещения одной небольшой области за раз. Между тем, платформа записывает поведение с помощью камеры в течение до трех часов и использует фирменное программное обеспечение MScan для управления экспериментом и интеграции данных.
Это создает трехмерное изображение до 10 000 нейронов на обширной площади ткани — способность, которая помогла Дэниелу Домбеку, нейробиологу из Северо-Западного университета в Эванстоне, штат Иллинойс, и его команде сделать неожиданное открытие. Чтобы определить схемы, которые могли бы позволить мыши отслеживать свою собственную активность, исследователи поместили каждую мышь на катящийся шарик под микроскопом с фиксированной головой и спроецировали вокруг нее лабиринт виртуальной реальности. Пока мышь бегала по виртуальному лабиринту, они записывали ее нейронную активность, чтобы увидеть, какие цепи мозга на самом деле используются.
Действительно, исследование выявило схему, которая загоралась, когда мышь была активна. Но оно также выявило близлежащие нейронные цепи, которые загорелись после того, как животное перестало двигаться. Они показали, что эти схемы приблизительно отслеживают, как долго мышь отдыхала, сообщили он и его команда в журнале Neuron. Недавно обнаруженные цепи расположены в той части мозга, где начинается болезнь Альцгеймера. Поскольку здоровые люди оценивают время лучше, чем люди с ранней стадией болезни Альцгеймера, наблюдение за этими цепями может привести к простому тесту на ранние стадии болезни, предполагает Домбек.
Визуализация более глубоких слоев мозга
Чтобы еще глубже заглянуть в мозг, исследователи теперь начинают возбуждать скрытые флуорофоры тремя фотонами, которые имеют еще более длинные волны и меньшую энергию. В двухфотонной микроскопии используются фотоны с длиной волны 800–1100 нм, которые могут проникать в мозг на глубину 0,5–1,0 мм. Но Крис Сюй, физик из Корнелльского университета, и его коллеги используют три фотона с длиной волны 1700 нм, которые могут проникать в ткань мозга на глубину до 1,5 мм без рассеяния. Этот метод также более четко фокусирует возбуждающий свет, оставляя меньше рассеянного света, размывающего изображение.
«Эта дополнительная глубина на самом деле очень важна», — говорит Джек Уотерс, исследователь из Института наук о мозге Аллена. «Мы можем получить доступ к большей части коры головного мозга с помощью двухфотонного микроскопа. Но, конечно, бывают обстоятельства, когда вы действительно не можете добраться до более глубоких слоев этой сети. Тогда вам, возможно, придется перейти к трехфотонным микроскопам».

Трехфотонная микроскопия, которая в настоящее время основана на изготовленных по индивидуальному заказу установках, может даже увидеть череп насквозь и получить изображение мозга на глубину около 0,5 мм. Сюй и нейробиолог Джозеф Фетчо, изучающий аутизм, недавно использовали трехфотонный микроскоп для получения изображений мозга живой взрослой рыбки данио. Рыбки данио популярны в исследованиях развития мозга, поскольку в молодости их черепа полупрозрачны, но с возрастом они становятся непрозрачными . Глядя сквозь череп, можно было бы лучше сравнить взрослого человека с подростком.
Трехфотонная микроскопия также может исследовать мозг более крупных животных. У Уотерса есть коллеги, которые нацеливают двухфотонные микроскопы на зрительную кору макаки, которая напоминает человеческую. Но этот метод проникает только во второй слой шестислойной коры. Большая часть интересной деятельности происходит на четвертом и пятом слоях. По его словам, с помощью трехфотонной техники «мы ожидаем, что сможем получать изображения большей части, а возможно, и всего пути через кору».
Лазеры, используемые в многофотонной микроскопии, продолжают развиваться, равно как и флуоресцентные метки и методы их доставки, и теперь эта технология может визуализировать нейроны и синапсы в больших объемах мозга во многих областях мозга. По словам Куна, по мере совершенствования технологии и появления в отрасли большего количества готовых систем это поможет ответить на еще больше вопросов в области науки о мозге. «Многие люди этим занимаются», — говорит он. «Это слишком увлекательно, чтобы этим могли заниматься лишь несколько человек».