Краткое введение
Фотохимия завоевывает мир синтетической химии. Она полезна для получения интересных и важных соединений способами, которые могут быть проще, безопаснее или невозможны при использовании традиционных термических методов. Если говорить более конкретно, то для наших целей мы имеем в виду фотоокислительный катализ в видимом свете - каталитические реакции, инициируемые каким-либо образом видимым светом. В наши дни трудно прочитать химический журнал и не увидеть множество новых протоколов, использующих видимый свет в качестве ключевого реагента в химическом превращении.

Стартовый набор HepatoChem, который включает в себя все необходимое, в том числе четыре примера реакций
Основы фотоокислительного катализа
Если вы химик, то велики шансы, что в какой-то момент вы нагревали колбу. Причина, по которой вы это делали, - преодоление энергии активации реакции, барьера, необходимого для ее протекания (см. рис. 1). При увеличении энергии в системе появляется достаточно энергии для того, чтобы два реагента соединились, создали или разорвали связи и перешли на другую сторону.
В фотоокислительном катализе мы хотим использовать фотоактивное соединение для передачи энергии света в химическую энергию, которая может быть использована для запуска химической реакции. Фотоны (свет) - это энергия в ее наиболее концентрированной форме, однако большинство химических реакций не могут получить доступ к этой энергии полезным или контролируемым образом. Активация химических реакций с помощью света основывается на двух законах фотохимии:
- Свет должен быть поглощен молекулой, чтобы произошла химическая реакция. (закон Гроттуса-Драпера).
- На каждый фотон света, поглощенный молекулой, приходится только одна молекула, активированная для фотохимической реакции. (закон Штарка-Эйнштейна).
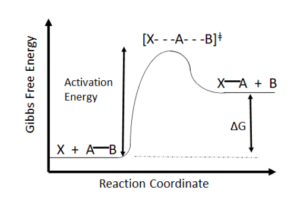
Рисунок 1: Диаграмма свободной энергии Гиббса
Понятия света и тепла
Свет обычно делится на три категории: ультрафиолетовый (от 100 до 380 нм), видимый (380-700 нм) и инфракрасный (более 700 нм). Количество энергии в свете наиболее велико при коротких длинах волн и гораздо меньше при длинных. Ультрафиолетовый свет достаточно силен, чтобы напрямую разрушать химические связи и инициировать свободнорадикальные реакции и радикальные перегруппировки. Для синтетических целей вспомните такие классические реакции, как [2+2] фотоциклоприсоединение α,β-ненасыщенных кетонов к алкенам. Такая высокая энергия, однако, делает переносимость функциональных групп очень низкой. Ультрафиолетовое излучение обладает достаточной энергией, чтобы непосредственно повредить ДНК и вызвать сильный солнечный ожог, но не проникает глубоко в кожу.
Инфракрасное излучение - самое слабое, невидимое человеческому глазу и относится к тому, что обычно воспринимается как "тепловое излучение". Инфракрасное излучение испускается и поглощается молекулами при вращении и колебаниях и полезно с химической точки зрения для изомеризации, реакций расщепления и активации пролекарств in vivo. Красный свет может проникать сквозь материалы наиболее далеко, проходя через вашу кожу с минимальным поглощением.
Между этими двумя крайностями находится видимый свет (как вы уже догадались, свет, который можно увидеть невооруженным глазом). На видимый свет приходится почти вся энергия, используемая живыми существами на Земле, после того как она преобразуется в углеводы в процессе фотосинтеза. К счастью для нас, большинство химических веществ вокруг нас не поглощают много света в видимой области, а когда поглощают, то мало что происходит. В общем, большинство вещей довольно инертны к видимому свету.
Что делает фотокатализатор хорошим
Если вернуться к нашей схеме реакции, то для того, чтобы получить химический доступ к видимой энергии света, фотон должен быть поглощен чем-то в процессе реакции. Часто нам нужен определенный тип молекул с сильными полосами поглощения в видимой области, например, сильно сопряженные органические красители или комплексы металлов с громоздкими ароматическими лигандами. Соединения, которые возбуждаются под действием света и могут передавать энергию другому веществу, называются фотосенсибилизаторами. Для наших целей это фотокатализаторы.
Что же делает фотокатализатор хорошим? Как минимум, нам нужен катализатор, способный поглощать свет в видимой области (где большинство субстратов инертны), что приводит к возникновению возбужденного состояния. Нам нужно, чтобы это возбужденное состояние жило достаточно долго, чтобы в нем проходили бимолекулярные реакции (с нашими субстратами). Часто катализатор в основном состоянии является плохим одноэлектронным окислителем или восстановителем (иначе он может вступить в нежелательные реакции), однако при возбуждении светом он превращается в мощный агент с одноэлектронным переносом. Кроме того, катализатор должен быть стабилен к химическим реакциям, которые вы хотите активировать, и не иметь других взаимодействий с химическими реакциями, которые вы проводите (если только они не продуктивны, тогда, конечно, это выгодно).
Существует большое количество хорошо изученных коммерчески доступных фотокатализаторов благодаря их широкому применению в возобновляемой энергетике, визуализации и биологических приложениях. Наиболее распространенными являются металлоорганические фотокатализаторы, многие из которых основаны на металлах рутений и иридий с полипиридиловыми лигандами. Кроме того, эффективными фотокатализаторами являются органические красители, такие как MesAcr и Eosin Y. Иногда катализатор может даже не понадобиться. Боясь пропустить обсуждение чьего-то любимого катализатора, приведем несколько наиболее распространенных фотокатализаторов (см. рис. 2 ниже).
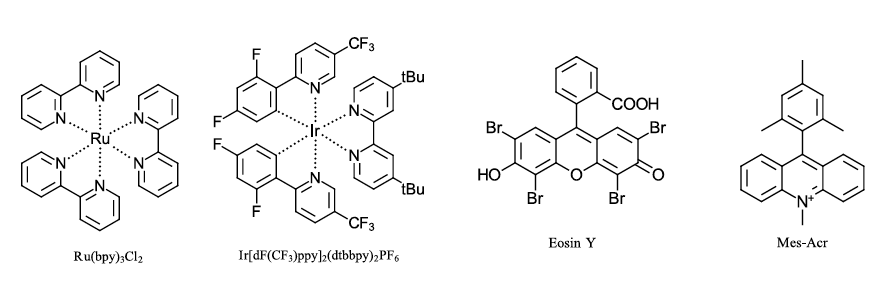
Рисунок 2: Часто используемые катализаторы для фотоокислительных превращений.
Возбужденные состояния и активация сложных превращений
В большинстве случаев фотохимии для фотокатализатора необходимо учитывать три важных электронных состояния: S0, S1 и T1 (см. рисунок 3). Когда молекула в основном состоянии (S0) поглощает один фотон света, это приводит к возбуждению одного электрона на более высокую молекулярную орбиталь (S1). В соответствии с правилами выбора спина этот электрон сохраняет свой спин на новой орбитали в синглетном состоянии. Множественные синглетные состояния возможны на возрастающих энергетических уровнях; однако высокоэнергетическая природа этих синглетов предполагает, что они должны быстро релаксировать путем распада или внутреннего преобразования обратно в S1. Непродуктивно для химических превращений, S1 может релаксировать обратно в S0 путем внутренней конверсии с потерей энергии в виде тепла или может также испускать фотон через флуоресценцию.
Важным для роли "катализатора" является то, что S1 может подвергаться межсистемному переходу (ISC) с инверсией спина для генерации возбужденного триплетного состояния T1. Это новое состояние T1 должно иметь более низкую энергию и более длительное время жизни, чем состояние S1, и, таким образом, может существовать с достаточным временем жизни для осуществления бимолекулярных реакций через перенос энергии (EnT) или перенос электронов (ET). Непродуктивно, T1 может релаксировать обратно в S0 либо путем внутренней конверсии, либо путем испускания фотона через фосфоресценцию.
Это новое состояние T1, время жизни которого варьируется от микро- до миллисекунд, обладает двумя интересными особенностями. Благодаря наличию наполовину заполненной низкоэнергетической орбитали катализатор возбужденного состояния является значительно более окислительным, чем катализатор основного состояния. В то же время состояние T1 имеет неспаренные выборы на высокоэнергетической орбитали и может выступать в качестве сильного восстановителя. Эта уникальная особенность возбужденных фотокатализаторов, способность отдавать или принимать электрон по мере необходимости, открывает широкие возможности для новых каталитических циклов, в которых возбужденный фотокатализатор присутствует для регулирования окислительных и восстановительных стадий по мере необходимости.
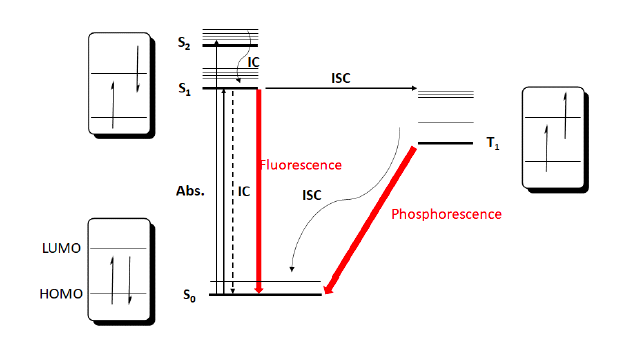
Рисунок 3: Схема Яблонского для возбуждения фотокатализатора
Ru(bpy)3 - наиболее широко используемый фотокатализатор с хорошо известными фотохимическими свойствами, подходящими для фотоокислительного катализа [Tucker, J. et al., 2012]. Во-первых, Ru(bpy)32+ с сильным максимумом поглощения ~450 нм в видимой области может быть возбужден флуоресцентными лампами, светодиодами, Xe-лампами и солнечным светом (рис. 4а). Возникающее триплетное состояние *[Ru(bpy)3]2+ имеет значительное время жизни (1 мкс), достаточное для одноэлектронного переноса (ОЭП) на органические молекулы. Возбужденное состояние может проходить либо через цикл восстановительного тушения (рис. 4b, c), либо через цикл окислительного тушения (рис. 4d, e), действуя как 1 e-окислитель и 1 e-восстановитель с образованием реактивных видов с открытой оболочкой (A-- или D-+).
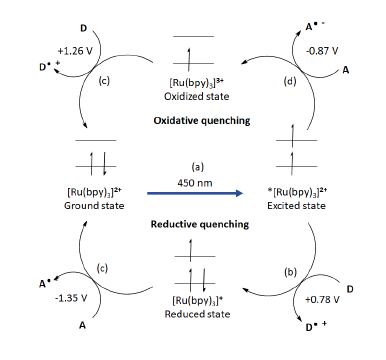
Рисунок 4. Возбужденное состояние Ru(bpy)3, приводящее к окислительному и восстановительному циклам тушения.
Неудивительно, что хорошо отлаженный каталитический цикл для Ru(bpy)3 был использован для фотоокислительных реакций, которые положили начало интересу к этой области (см. рис. 5). Начиная с 2008 года, первые сообщения трех групп о трех различных реакциях, а.) циклоприсоединении 2+2 [Ischay, M. A.; et al. 2008], б.) дегалогенировании [Narayanam, J. M. R.; et al. 2009], в.) органокатализируемом алкилировании альдегидов [Nicewicz, D. A.; et al. 2008], демонстрируют первые перспективы света в качестве реагента. После этих трех сообщений химики повсеместно стали использовать свои лампы для выращивания, фонарики и светодиодные ленты, построили самодельные реакторы и начали открывать невероятно полезные химические превращения.
За последующие 12 лет количество полезных реакций заполнило множество обзоров и слишком велико, чтобы подробно обсуждать их здесь. Вы можете прочитать о металлофоторедукции [Shaw, M. H.; et al. 2016], органических красителях [Romero, N., et al, 2016], влиянии фоторедукции на синтез [Marzo, L.; et al. 2018] и реакциях в потоке [Harper, K. Moschetta, et al, 2019] и др. Практически неограниченное количество фотосенсибилизирующих соединений коммерчески доступно для опробования, а новые катализаторы продолжают расширять границы возможного (например, недавно Мияке продемонстрировал фотохимическую реакцию Берча [Justin P. Cole, et al, 2020]). Однако, возможно, наиболее актуальной для многих химиков-медиков является реакция, описанная Макмилланом и соавторами, сочетающая иридиевый фотоокислительный цикл для активации катализируемых никелем металлоорганических циклов (см. рисунок 6) [Zuo, Z., et al, 2014]. Эта парадигма реакции, использующая фотоокислительный цикл для активации металлоорганического цикла, позволила получить фотоокислительные версии многих традиционных металлоорганических химических перекрестных связей (C-C, C-N, C-O, C-S), традиционно осуществляемых термически с палладиевыми, никелевыми, медными катализаторами [Shaw, M. H.; et al. 2016].
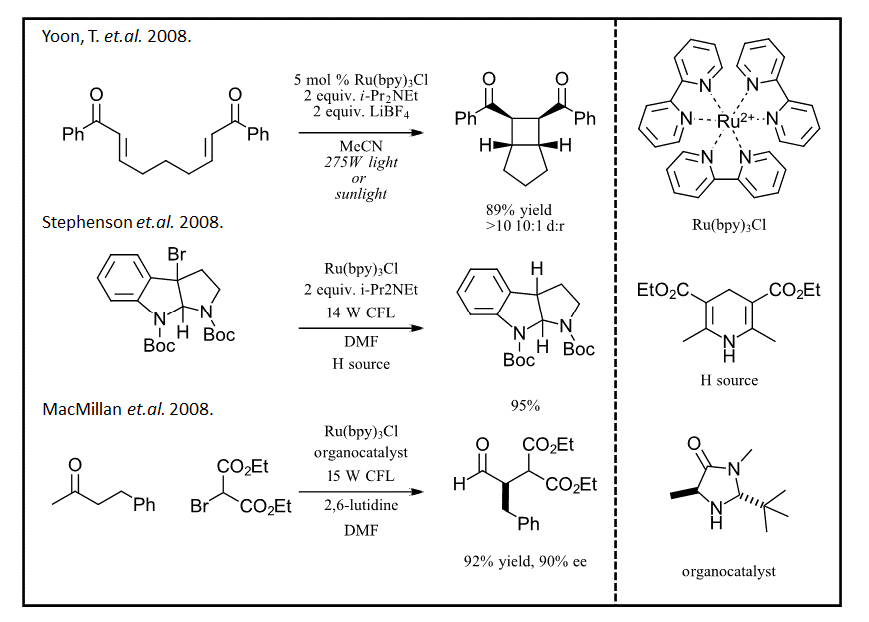
Рисунок 5: Возрождение фоторедукции, начавшееся в 2008 году
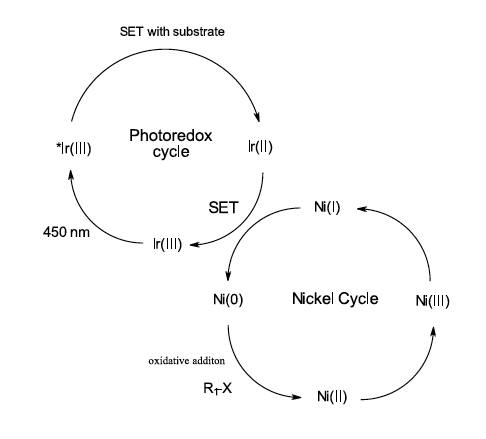
Рисунок 6: Фотоокислительная активация металлоорганического цикла
За последнее десятилетие были открыты фотохимические параллели многих традиционных "именных" металлоорганических реакций перекрестного присоединения. Как только мы можем преобразовать видимый свет в химическую энергию, фотоокислительный катализ позволяет проводить химические превращения с рядом потенциальных преимуществ по сравнению с соответствующей термической реакцией:
- Комнатная температура по сравнению с зачастую высокими температурами
- Более низкая нагрузка на катализатор
- Легкий доступ к реактивным видам с открытой оболочкой без необходимости использования стехиометрических окислителей/восстановителей или радикальных инициаторов (например, исключение токсичных оловянных реагентов)
- Активация вялотекущих каталитических циклов
- Доступ одновременно к окислительным и восстановительным условиям














