Авторы: Wolfgang Becker, Alexander Jelzow, Vladislav Shcheslavskiy
Аннотация
При визуализации времени жизни флуоресценции (Fluorescence Liftime Imaging - FLIM) записываются изображения, которые содержат полную функцию времени затухания флоуресценции в каждом пикселе. Параметры затухания являются показателями молекулярной окружающей среды флуорофоров. Поэтому FLIM позволяет получить непосредственную информацию о концентрации ионов, pH факторе, белках и конфигурации белковых взаимодействий, а также метаболического состояния клеток и тканей. Метод FLIM, использующий счет одиночных фотонов с корреляцией по времени (Time Correlated Single Photon Counting - TCSPC), основан на сканировании исследуемого образца с высокой частотой импульсного лазерного излучения, регистрации единичных фотонов флоуресцирующего сигнала, формировании распределения фотонов по временам фотонов в периоде импульса лазерного излучения и координат лазерного луча в области сканирования в момент регистрации фотонов. Метод превосходно сочетает в себе преимущества счета фотонов с корреляцией по времени и лазерной сканирующей микроскопии: это обеспечивает почти идеальную эффективность регистрации фотонов, минимальное время облучения образца, высокое временное разрешение, многоэкспоненциальное разложение профилей, а также подавление внефокусного и бокового рассеянного света.
Введение
Методы визуализации, основанные на флуоресценции нашли широкое применение в исследованиях клеток и живых организмов, потому что они чрезвычайно чувствительны и способны предоставлять информацию о биохимических взаимодействиях на молекулярном уровне. Интенсивность флуоресценции зависит от квантовой эффективности флуоресценции и концентрации флуорофора. Изображения интенсивности флуоресценции показывают, где в образце находятся флуорофоры, т.е. показывают пространственное строение исследуемого образца. Спектр флуоресценции является характерным для флоурофора. Изображения содержат спектральную информацию, позволяя определить флуорофоры в отдельных пикселях изображения. Время жизни флуоресценции или, точнее, функция затухания флуоресценции зависит от типа флуорофора, а не от их концентрации. Также она зависит и от молекулярной среды флуорофора. Функция фруоресцентного затухания и, следовательно, флуоресцентные изображения содержат информацию о молекулярном окружении молекул флуорофора или флуоресцентномеченных биомолекул [5, 12, 31].
Существует ряд различных методов для обнаружения флуоресценции и совместимости обнаруженной флуоресценции с визуализацией. Разные принципы отличаются эффективностью регистрации фотонов, т.е. числом фотонов, необходимых для получения заданной точности времени жизни [26, 39], времени регистрации необходимого для записи этих фотонов, потока фотонов при котором они используются, временным разрешением, их способностью в разложении параметров нескольких экспоненциальных функций распада, многоволновых возможностях, возможностью оптических срезов и совместимостью с различными методами визуализации и микроскопии [5]. В данной статье основной упор будет сделан на FLIM со счетом одиночных фотонов с корреляцией по времени и методе лазерного сканирования, который обеспечивает выдающееся сочетание эффективности регистрации фотонов, временное и пространственное разрешение [11].
Классический метод TCSPC возбуждает образец с помощью импульсного лазера, обнаруживает единичные фотоны флуоресцирующего света и строит распределение фотонов (или гистограммы) плотности фотонов, возбужденных лазерным импульсом от эффективности регистрации фотонов. Этот метод известен с 1961 года [15], полный обзор можно найти в [36]. Ограничением классического метода является то, что он одномерный. Он не передаёт изображения напрямую, и он не может использоваться в сочетании с быстрым сканированием, применяющимся в современных лазерных сканирующих микроскопах [37].
Проблема классического TCSPC метода была решена с помощью многомерного TCSPC, представленного компанией Becker & Hickl в 1993 году. В данном случае процесс записи формирует распределение фотонов не только с течением времени после импульса возбуждения, но и по другим параметрам, таким как положение лазерного луча в области сканирования в момент регистрации фотона, длина волны фотонов или время от начала эксперимента [1, 8, 11]. Применение многомерного TCSPC метода в лазерной сканирующей микроскопии показано на рисунке 1.
Сканирующая головка микроскопа сканирует исследуемый образец сфокусированным пучком импульсного лазера высокой частоты. Для каждого обнаруженного фотона в TCSPC приборе определяется время t, период лазерного импульса, местоположение лазерного пятна x, y в области сканирования. Из этих параметров строится распределение фотонов по пространственным координатам x, y и времени фотонов t. Процесс записи продолжается в течение большого числа периодов до тех пор, пока полезный уровень сигнал/шум фотонного распределения не будет достигнут. Пожалуйста, смотрите [8] для более подробной технической информации.
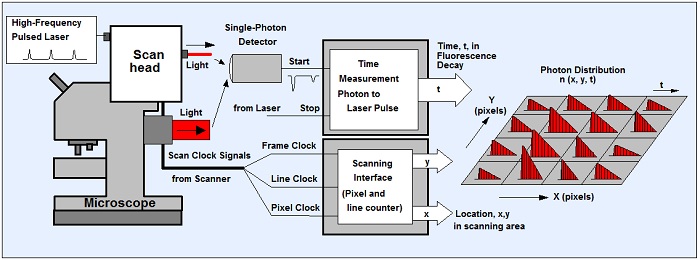
Рис. 1. Принцип метода TCSPC FLIM
Среди всех электронных методов FLIM многомерный TCSPC метод обеспечивает высокое временное разрешение. Он также позволяет получить лучшую точность времени жизни или эффективность регистрации фотонов при заданном числе фотонов зарегистрированных от образца [26, 39]. Метод TCSPC FLIM имеет ряд других особенностей, важных для визуализации времени жизни биологических систем: он способен решать сложные профили кинетики затухания, устойчив к динамическим изменениям в параметрах затухания флуоресценции [1, 8]. Кроме того метод TCSPC FLIM прекрасно совместим с конфокальной и многофотонной [19, 37] лазерной сканирующей микроскопией. Он не имеет никаких проблем совместимости с высокой скоростью сканирования используемой в этих системах: процесс записи продолжается в течении всего времени сканирования для получения необходимого соотношения сигнал/шум. Кроме того метод TCSPC FLIM использует оптические срезы конфокального или многофотонного сканирования: данные получены из точно определённой боковой позиции и с точно определённой плоскостью в образце, без загрязнения боковым рассеянием и внефокусной флуоресценцией [11].
TCSPC FLIM
Принцип TCSPC FLIM
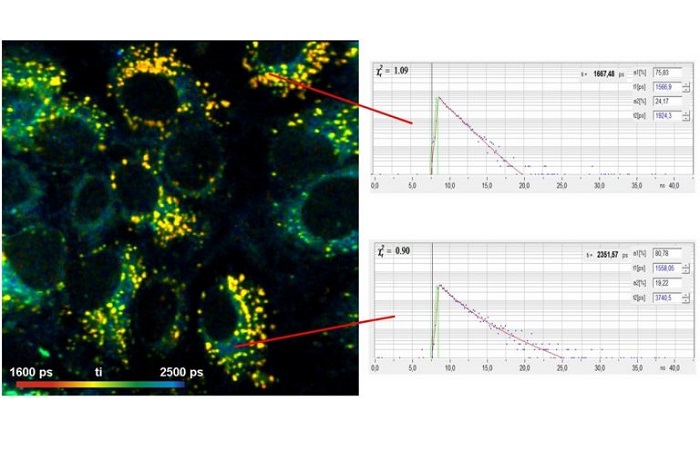
На рисунке 2 приведён пример данных высокого качества, которые могут быть получены c помощью метода TCSPC FLIM. Изображение размером 2048 х 2048 пикселей и функцией флуоресцентного затухания в отдельных пикселях в 256 временных каналах.
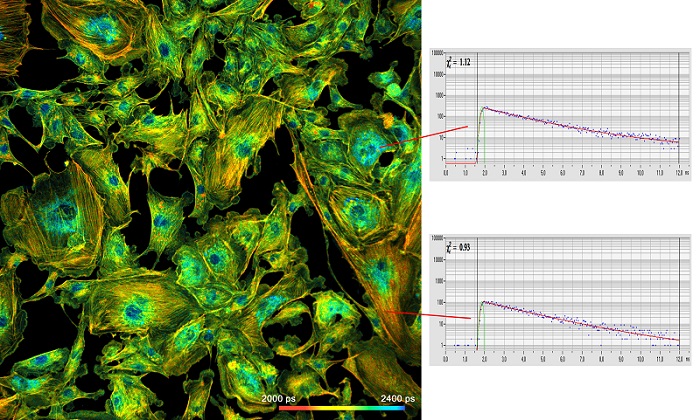
Рис. 2: Слева: Изображение просканированных эндотелиальных клеток коровьей легочной артерии (BPAE) с разрешением 2048 x 2048 пикселей и 256 временных каналов на пиксель. Использовалась система DCS-120 компании Becker & Hickl, микроскоп Axio-Observer компании Zeiss с объективом 20x NA = 0.5. Справа: кинетика затухания флуоресценции в двух выбранных пикселях. Адаптировано из [9].
Применение метода FLIM в биологии
Измерение параметров молекулярного окружения
Существует широкий спектр флуорофоров, также называемые «датчики» или «пробники», изменение времени жизни которых зависит от локального молекулярного окружения [31]. Широко известными являются датчики концентрации ионов, такие как Oregon Green Bapta для Ca2+ или MQAE для Cl-. Другие датчики изменяют своё время жизни в зависимости от значения pH или при привязке к ДНК и РНК. Есть также эффекты локальной вязкости, агрегации флуорофора и переноса электронов [5, 11, 12, 31, 40]. Пример для измерения Ca2+ показан на рисунке 3.
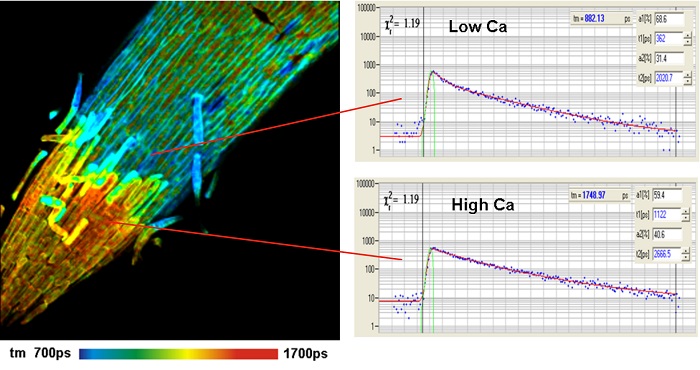
Рис. 3. Кончик корня ячменя покрытый флуорофором Oregon Green Bapta. Предоставлено: Feifei Wang, Zhonghua Chen & Anya Salih, University of Confocal Bioimaging Facility, University of Western Sydney, Australia. Использовался микроскоп Leica SP5 MP с FLIM модулем SPC-150 компании Becker&Hickl. Из [8].
Преимуществом FLIM над методами на основе измерения интенсивности является то, что результаты являются независимыми от (переменной) концентрации флуорофора и вариации поглощения в исследуемом образце.
FRET эксперименты
Одним из наиболее широких применений метода TCSPC FLIM является измерение белковых взаимодействий и сворачивания белков путём Ферстеровского резонансного переноса энергии (Förster resonance energy transfer - FRET) [22, 23]. Белки помечаются двумя красителями с различными спектрами поглощения и излучения. Полосы излучения первого красителя (донора) перекрывают полосы поглощения второго (акцептора). Если расстояние между донором и акцептором меньше нескольких нанометров, то энергия может передаваться непосредственно от донора к акцептору. В результате происходит уменьшение времени затухании флуоресценции донора. Интенсивность передачи энергии, т.е. уменьшение времени затухания является показателем расстояния между донором и акцептором.
Использование метода FLIM для FRET экспериментов имеет очевидное преимущество - интенсивность FRET получается из единичного времени жизни донора. Акцепторное изображение не требуется, и утечки донора в акцепторный канал и напрямую возбуждённая флуоресценция акцептора не имеют никакого влияния на результат измерения метода FLIM-FRET. Единственное значение, которое требуется для вычисления FRET - это время затухания донора в отсутствии акцептора. [14, 17, 21, 38]. Зачастую это значение можно получить при помощи анализа кинетки затухания донора двойной экспоненциальной функцией [8].
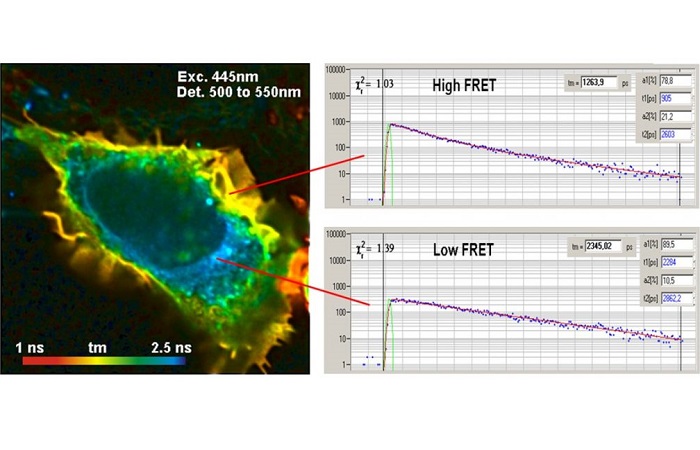
Пример результата метода FLIM FRET показан на рисунке 4. Данные были получены из клеток, экспрессирующих синтез зеленого флуоресцентного белка. Су3-меченное антитело использовали в качестве акцептора для FRET.
Огромное количество FLIM-FRET работ были опубликованы в последние несколько лет, большинство из них с помощью TCSPC FLIM. Пожалуйста, смотрите [8] для обзора литературы и для получения дополнительной информации.
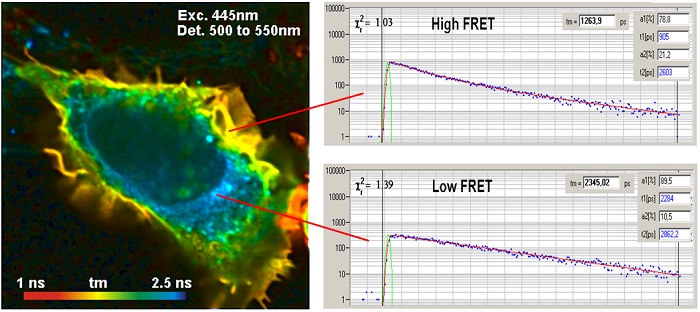
Рис. 4. Клетки, содержащие синтез зеленого флуоресцентного белка (донора) и Су3-меченные антитела (акцептор). Изображение донора, анализ с помощью двойного экспоненциального распада, амплитудно-взвешенное время жизни. Использовался микроскоп Zeiss LSM 710 с FLIM системой Simple-Tau 152 компании Becker & Hickl.
FLIM автофлуоресценции
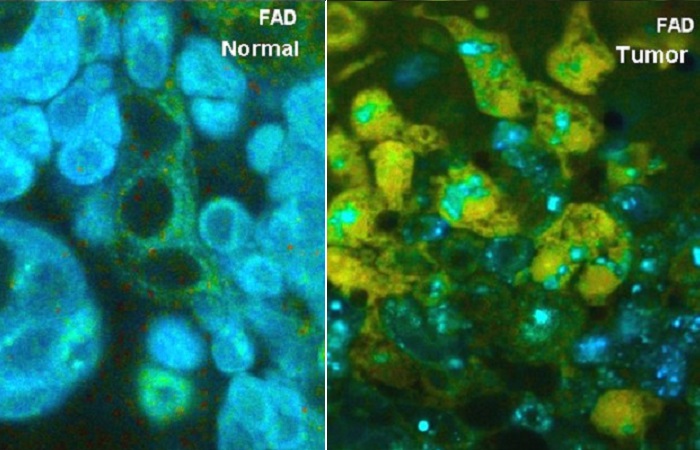
Биологическая ткань содержит широкий спектр эндогенных флуорофоров, время жизни которых зависит от локальных параметров окружающей среды, таких как насыщенность кислородом, связь с белками, а главное состояние метаболизма ткани [13, 18, 40, 43]. Данные FLIM содержат прямую биологическую информацию [11]. Дополнительная информация о строении ткани может быть получена при помощи генерации сигналов второй гармоники [25, 34]. Важным аспектом является то, что автофлуоресцентная визуализация не использует экзогенные метки. Поэтому метод может напрямую быть использован в клинических исследованиях.
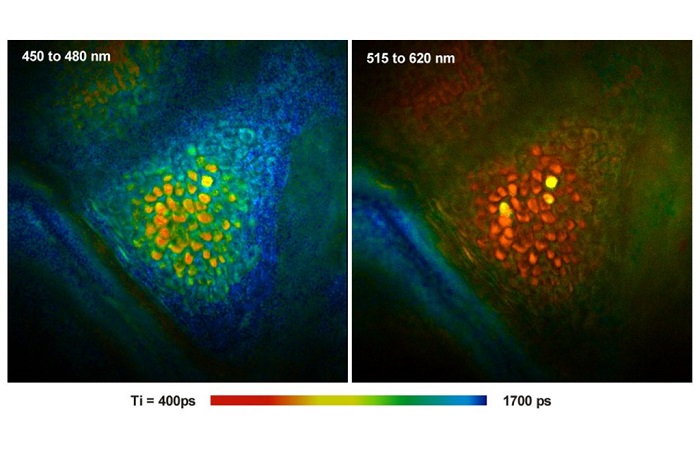
Автофлуоресцентное изображение биологической ткани может содержать на удивление много деталей, смотрите рисунок 5. На изображениях показан образец кожи свиньи при двухфотонном возбуждении на длине волны 800 нм. На рисунке слева показан канал детекции на длине волны менее 480 нм. Этот канал содержит как флуоресценцию, так и генерацию сигналов второй гармоники. Часть сигнала генерации второй гармоники была получена из данных FLIM и отображается цветом. На правом рисунке показан канал на длине волны больше 480 нм. Он содержит только флуоресценцию, цвет соответствует амплитудно-взвешенному среднему времени затухания полученного из модели двойного экспоненциального распада.
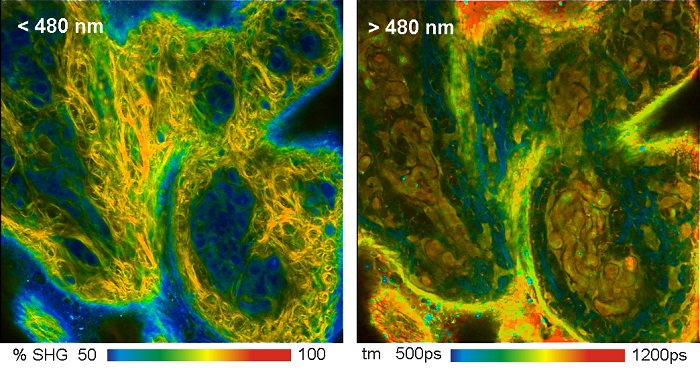
Рис. 5. Изображения FLIM образца кожи свиньи при двухфотонном возбуждении. На левом изображении длина волны канала меньше 480 нм, цвета показывают процент от генерации второй гармоники в записанном сигнале. На правом изображении длина волны канала больше 480 нм, цвета показывают амплитудно-взвешенное среднее время жизни. Использовался микроскоп Zeiss LSM 710 NLO с FLIM системой Simple-Tau 152 компании Becker&Hickl. Из [5].
Использование FLIM в клинических исследованиях
При многофотонной томографии человеческой кожи используется лазерное сканирование с помощью сфокусированного фемптосекундного лазерного луча, двухфотонного возбуждения и регистрации сигналов флуоресценции, не требующих десканирования [29, 40]. Методика берёт своё начало в работах Граттона, Кенига, Мастерса, Со и Тромберга, которые показали, что в живых организмах двухфотонная визуализация автофлуоресценции клеток и, в особенности человеческой кожи, может производиться без ущерба для их жизнедеятельности [27, 28, 33, 34]. Инструменты для клинического применения методики были разработаны компанией Jenlab GmbH (Йена, Германия) [24]. Поскольку методика основана на быстром сканировании и импульсном возбуждении, то она хорошо сочетается с методом TCSPC FLIM. На рисунке 6 показан зернистый слой человеческой кожи (stratum granulosum), записанный системой Jenlab 'Dermainspect' и FLIM TCSPC системой SPC-152 компании Becker & Hickl.
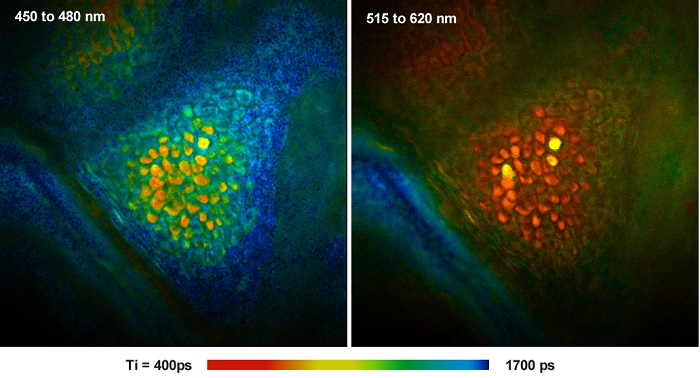
Рис. 6. FLIM изображения живой человеческой кожи полученные на мультифотонном томографе Jenlab Dermainspect и TCSPC FLIM системе SPC-152 компании Becker & Hickl. Двухфотонное возбуждение на длине волны 750 нм. Из [8]. Данные предоставлены Майклом Робертсом и Вашингтоном Санчесом из университета Квинсленда, Брисбен, Австралия.
Для применений связанных с офтальмологией в методе FLIM используется сочетание офтальмологического сканера с одним или двумя пикосекундными диодными лазерами и TCSPC FLIM системой. Для получения подробной технической информации, смотрите [8, 11]. Офтальмологический FLIM в настоящее время проходит клинические испытания [20, 42]. Два типовых полученных результата показаны на рис. 7. Изображения были отсканированы с помощью метода FLIO (Fluorescence Lifetime Imaging Ophthalmoscopy) для съёмки времени жизни лазерным офтальмоскопом фирмы Heidelberg Engineering (Германия). Детекторная часть системы имеет два спектральных канала от 490 нм до 560 нм и от 560 нм до 700 нм. Сигналы регистрировались с помощью гибридных детекторов HPM-100 фирмы Becker&Hickl [3] и записывались TCSPC FLIM модулями для счета фотонов SPC-150. Представлены изображения с длинами волн канала от 560 нм до 700 нм.
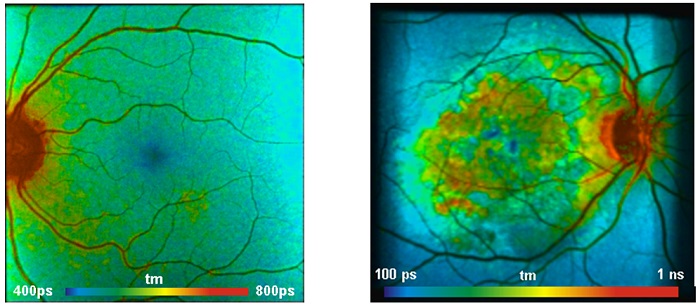
Рис. 7. Слева: изображение времени жизни глазного дна левого глаза автора (WB). Справа: изображение времени жизни глазного дна пациента с возрастной дегенерацией желтого пятна. Из [8], данные предоставлены Дитрихом Швейцером, Фридрихом Шиллером из университета Йены, Германия.
Изображения TCSPC FLIM других органов могут быть получены путём сканирования через эндоскопы. Оптический принцип был продемонстрирован с хорошими результатами [8]. В настоящее время проблемой является отсутствие клинических испытаний эндоскопов с высокой числовой апертурой и низкой собственной флуоресценцией.
Последние разработки
За последние 10 лет методы FLIM добились впечатляющего прогресса. Обычные фотоэлектронные умножители (ФЭУ) были заменены однофотонными лавинными фотодиодами и гибридными детекторами. Эти детекторы имеют значительно более высокую эффективность регистрации фотонов, чем традиционные ФЭУ. Гибридные детекторы обеспечивают получение более чистых сигналов [3]. Таким образом они не только регистрируют большее число фотонов, но и позволяют FLIM системам достигать более высокой точности измерения времени жизни для заданного числа фотонов на пиксель. В последние несколько лет скорость и объём памяти компьютеров увеличились более чем на порядок. 64-разрядные операционные системы и 64-битное программное обеспечение прибора увеличили доступный объём памяти. В результате данные FLIM могут быть записаны с мегапиксельным разрешением [8, 44], как показано на рисунке 2.
Повышение эффективности помогает избежать искажения результатов исследования связанных с фотоотбеливанием, фотоповреждением или фотоиндуцированнием метаболических изменений в исследуемых образцах. В сочетании с большим объёмом памяти для 64-разрядных систем основанных на Windows метод TCSPC FLIM может быть расширен с помощью дополнительных параметров фотонов или эксперимента. Одним из таких параметров является спектрально-разрешенный FLIM [1, 2]. Спектр флуоресцирующего света распределяется на матрицу из детекторных каналов. Для каждого фотона определяется время возбуждения лазерным импульсом, номер регистрирующего канала в детекторе, положение х и y лазерного пятна в области сканирования. Эти сведения используются для построения распределения фотонов по времени распада фотонов флуоресценции, длине волны и координаты изображения. В результате несколько изображений (обычно 16) различной длины волны одновременно записываются в одном TCSPC канале. Результат показан на рисунке 8. Также смотрите [2, 18, 41].
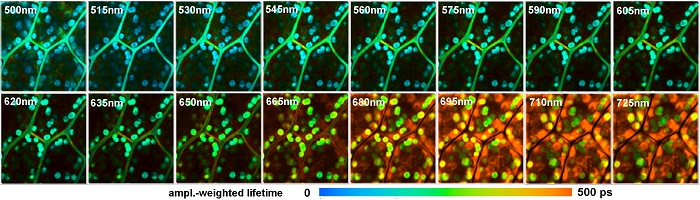
Рис. 8. Многоволновой FLIM биологической ткани растения, 16 интервалов длин волн, 128х128 пикселей, 256 временных каналов. Двухфотонное возбуждение на длине волны 850 нм, регистрация от 500 нм до 725 нм. Использовался микроскоп Zeiss LSM 710, многоволновые MW-FLIM детекторы, TCSPC FLIM система Simple-Tau 150 компании Becker&Hickl. Амплитудно-взвешенное время жизни полученное нелинейным приближением двойной экспоненциальной функции, нормировано по интенсивности.
Другой способ добавления дополнительных параметров для построения распределения фотонов в методе FLIM – это «мозаика». Мозаичный FLIM записывает данные последующих записей FLIM в следующие элементы FLIM большего массива данных. Этот метод первоначально был разработан для записи пространственных мозаичных данных при пошаговом перемещении образца [44]. Он может быть также использован для записи Z стеков FLIM данных и для записи быстрых временных рядов [8, 11]. Пример показан на рисунке 9. Мозаика имеет 64 элемента, каждый записан в течение 1 секунды. В качестве образца использовался листок мха, микроскоп с конфокальной FLIM системой DCS-120 компании Becker&Hickl. Время проходит от нижнего левого до верхнего правого угла. Отчётливо видно снижение времени жизни флуоресценции вызванного нефотохимическим переходом хлорофилла.
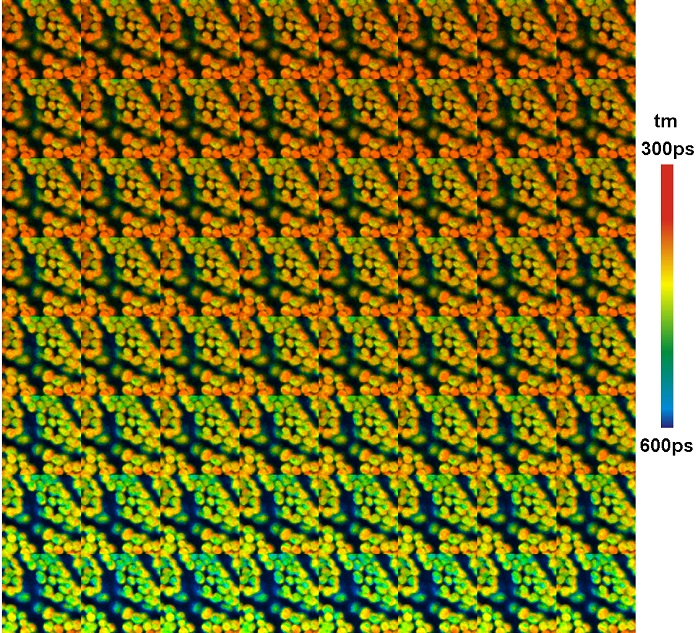
Рис. 9. Временной ряд записанный мозаичным изображением. 64 элемента мозаики для последовательных временных рядов после включения возбуждения светом. Время сбора одного элемента 1 секунда, общее время 64 секунды, размер изображения каждого элемента 128х128 пикселей, 256 временных каналов.
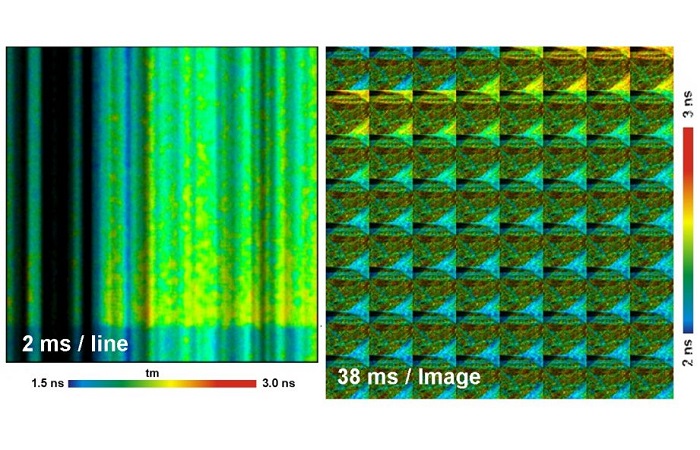
С помощью периодической стимуляции образца данная методика способна устранить изменения концентрации Ca2+ в живых нейронах при временном разрешении 40 мс [8, 11]. Ещё более быстрый метод называется флуоресцентное время жизни-переходных процессов сканирования (Fluorescence Lifetime-Transient Scanning - FLITS), который основан на TCSPC методике и сканировании отдельных линий. Метод FLITS был представлен для записи динамических эффектов времени жизни флуоресценции при временном разрешении около 1 мс [8, 6, 11].
В настоящее время всё больший интерес представляет метод FLIM в ближней инфракрасной области спектра. В ближней инфракрасной области эмиссия экзогенных флуорофоров может быть обнаружена без загрязнения от автофлуоресценции. Кроме того разложение флуоресценции флуорофоров ближней инфракрасной области спектра является актуальным для диффузных оптических методов визуализации [1, 8, 11]. Пример ближнего инфракрасного FLIM метода с помощью лазерного сканирующего микроскопа Zeiss LSM 710 NLO показан на рисунке 10. Технические детали ближнего ИК FLIM описаны в [7] и [8].
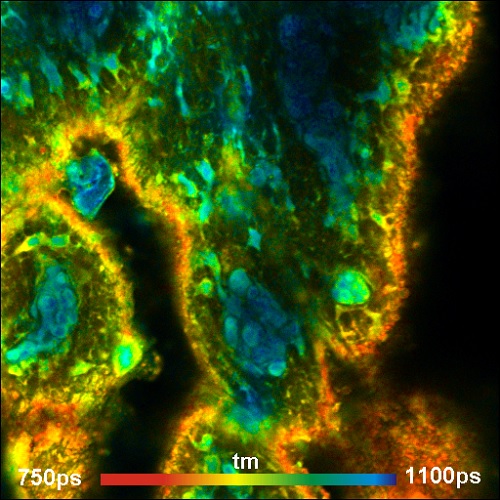
Рис. 10. Образец свинной кожи, окрашенный с диэтилтиатрикарбоцианином. Использовался микроскоп Zeiss LSM 710 NLO, Ti:Sa лазер для однофотонного возбуждения. Длина волны возбуждения 780 нм, регистрируемая длина волны от 800 нм до 900 нм, FLIM система Simple-Tau 152 с гибридным детектором HPM 100-50 компании Becker&Hickl. Поперечный размер изображения 212х212 мкм, глубина около 30 мкм от поверхности. Обратите внимание на высокую контрастность изображения.
Метод TCSPC FLIM может быть объединён cо STED микроскопией на основе подавления спонтанного испускания (Stimulated Emission Depletion (STED) Microscopy) [16, 32] и со сканирующей оптической микроскопией ближнего поля (Near-field Scanning Optical Microscopy - NSOM) [8, 35] для получения времени жизни флоуресценции изображения с оптическим супер-разрешением. Пример записи STED-FLIM показан на рисунке 11.
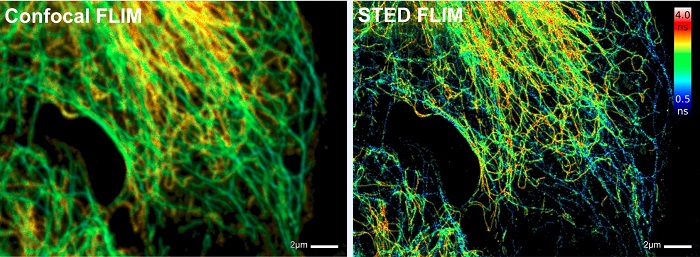
Рис. 11. Метод STED FLIM. Слева: конфокальное изображение. Справа: STED изображение. Клетки млекопитающих меченные тубулином / Atto647N и виментином/Abberior STAR 635P. Изображения предоставлены Андреасом Шёнле, Aberrior Systems (Гёттинген, Германия).
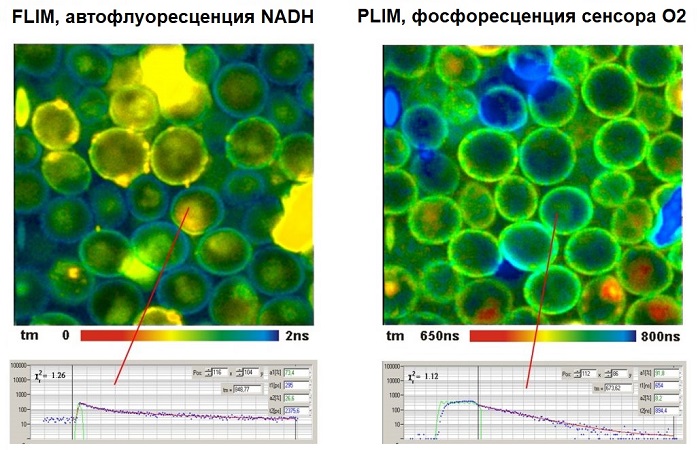
Метод TCSPC FLIM способен одновременно записывать визуализацию флуоресценциии (FLIM) и изображения фосфоресценции времени жизни (PLIM). Методика основана на модулирующем включении-выключении высокочастотного импульсного лазера и записи двух времён для каждого зарегистрированного фотона. Одним из них является время от предыдущего возбуждения импульса, другим – время от модуляции импульсов [8, 4].
Пример показан на рисунке 12 - дрожжевые клетки, окрашенные флуоресцентным веществом (2,2’-bipyridyl) dichlororuthenium (II) hexahydrate. На временной шкале пикосекундного масштаба обнаружена автофлоуресценция NADH и FAD. Фосфоресценция красителя рутения зафиксирована в микросекундном масштабе. Изображение времени жизни флуоресценции показано на рисунке слева, изображение справа – время жизни фосфоресценции.

Рис. 12. Слева изображение флуоресценции времени жизни и справа изображение фосфоресценции времени жизни дрожжевых клеток, окрашенных флуоресцентным веществом. Амплитудно-взвешенное среднее время жизни двойной экспоненциальной подстройки данных кривой затухания [8].
Методы основанные на комбинации конфокальной или двухфотонной лазерной сканирующей микроскопии с TCSPC, в принципе, также способны записывать данные флуоресцентной корреляционной спектроскопии (FCS следы) и FRET единичных молекул [8, 11]. Пример FCS записи представлен на рисунке 13.
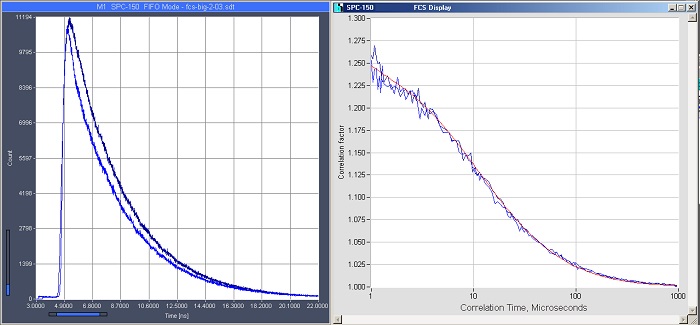
Рис. 13. FCS следы полученные с помощью лазерного сканирующего микроскопа Zeiss LSM 880. Возбуждение пикосекундным диодным лазером Zeiss 405 нм, регистрация детектором Zeiss BIG-2, запись TCSPC FLIM системой Simple-Tau 152 в режиме FCS следов. Два канала регистрации, кривые затухания показаны слева, кривые FCS следов справа.
Заключение
Сочетание многомерного метода TCSPС и лазерного сканирующего микроскопа позволяет записать визуализацию время жизни флуоресценции почти с идеальной эффективностью регистрации фотонов и превосходным временным и пространственным разрешением. Этот метод может быть расширен, чтобы записывать изображения на нескольких длинах волн, пространственные мозаики и Z стеки FLIM изображений, а также быстрые временные серии, показывающие динамическое изменение в поведении флуоресценции исследуемого образца. Кроме того флуоресцентное изображение времени жизни может быть записано одновременно с фосфоресцентным изображением времени жизни. Метод TCSPC FLIM может быть объединён со STED, в результате чего FLIM изображения будут записаны с оптическим супер разрешением. Типовым применением метода FLIM является отображение локальных молекулярных параметров окружающей среды, белковых взаимодействий по FRET методу и визуализация автофлуоресценции. Клиническое применение находится на стадии клинических исследований.
Литература
1. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York, 2005
2. W. Becker, A. Bergmann, C. Biskup, Multi-Spectral Fluorescence Lifetime Imaging by TCSPC. Micr. Res. Tech. 70, 403-409 (2007)
3. W. Becker, B. Su, K. Weisshart, O. Holub, FLIM and FCS Detection in Laser-Scanning Microscopes: Increased Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811 (2011)
4. W. Becker, B. Su, A. Bergmann, K. Weisshart, O. Holub, Simultaneous Fluorescence and Phosphorescence Lifetime Imaging. Proc. SPIE 7903 (2011)
5. W. Becker, Fluorescence Lifetime Imaging - Techniques and Applications. J. Microsc. 247, 119-136 (2012)
6. W. Becker, V. Shcheslavkiy, S. Frere, I. Slutsky, Spatially Resolved Recording of Transient Fluorescence-Lifetime Effects by Line-Scanning TCSPC. Microsc. Res. Techn. 77, 216-224 (2014)
7. W. Becker, V. Shcheslavskiy, Fluorescence lifetime imaging with near-infrared dyes, Photon Lasers Med 4, 73–83, 2015
8. W. Becker, The bh TCSPC handbook. 6th edition. Becker & Hickl GmbH (2015)
9. Becker & Hickl GmbH, DCS-120 Confocal Scanning FLIM Systems, user handbook, 6th ed. (2015)
10. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 510 and LSM 710/780/880 family laser scanning microscopes. User handbook, 6th ed. (2015)
11. W. Becker (ed.), Advanced time-correlated single photon counting applications. Springer, Berlin, Heidelberg, New York (2015)
12. M.Y. Berezin, S. Achilefu, Fluorescence lifetime maesurement and biological imaging. Chem. Rev. 110, 2641-2684 (2010)
13. D.K. Bird , L. Yan , K. M. Vrotsos , K. E. Eliceiri , E. M. Vaughan. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of coenzyme NADH. Cancer Res 65:8766–8773 (2005)
14. C. Biskup, L. Kelbauskas, T. Zimmer, K. Benndorf, A. Bergmann, W. Becker, J.P. Ruppersberg, C. Stockklausner, N. Klöcker, Interaction of PSD-95 with potassium channels visualized by fluorescence lifetime-based resonance energy transfer imaging, J. Biomed. Opt. 9, 735-759 (2004)
15. L. M. Bollinger, G. E. Thomas, Measurement of the time tependence of scintillation intensity by a delayed coincidence method. Rev. .Sci. Instrum. 32, 1044-1050 (1961)
16. J. Bückers, D. Wildanger, G. Vicidomini, L. Kastrup, S.W. Hell, Simultaneous multi-lifetime multi-colour STED imaging for colocalization anlysis. Opt. Expr. 19, 3130-3143 (2011)
17. Y. Chen, A. Periasamy, Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization, Microsc. Res. Tech. 63, 72-80 (2004)
18. D. Chorvat, A. Chorvatova, Multi-wavelength fluorescence lifetime spectroscopy: a new approach to the study of endogenous fluorescence in living cells and tissues. Laser Phys. Lett. 6 175-193 (2009)
19. Diaspro A. (ed.). Confocal and two-photon microscopy: Foundations, applications and advances. Wiley-Liss (2001)
20. C. Dysli, G. Quellec, M Abegg, M. N. Menke, U. Wolf-Schnurrbusch, J. Kowal, J. Blatz, O. La Schiazza, A. B. Leichtle, S. Wolf, M. S. Zinkernagel, Quantitative Analysis of Fluorescence Lifetime Measurements of the Macula Using the Fluorescence Lifetime Imaging Ophthalmoscope in Healthy Subjects. IOVS 55, 2107-2113 (2014)
21. R.R. Duncan, A. Bergmann, M.A. Cousin, D.K. Apps, M.J. Shipston, Multi-dimensional time-correlated single-photon counting (TCSPC) fluorescence lifetime imaging microscopy (FLIM) to detect FRET in cells, J. Microsc. 215, 1-12 (2004)
22. Th. Förster, Zwischenmolekulare Energiewanderung und Fluoreszenz, Ann. Phys. (Serie 6) 2, 55-75 (1948)
23. Th. Förster, Energy migration and fluorescence. Translated by Klaus Suhling. J. Biomed. Opt. 17 011002-1 to -10
24. Jenlab GmbH, MPT Flex Multiphoton Laser Tomography.
25. M. J. Koehler, K. König, P. Elsner, R. Bückle, M. Kaatz, In vivo assessment of human skin aging by multiphoton laser scanning tomography, Opt. Lett. 31, 2879-2881 (2006)
26. M. Köllner, J. Wolfrum, How many photons are necessary for fluorescence-lifetime measurements?, Phys. Chem. Lett. 200, 199-204 (1992)
27. K. König, P.T.C. So, W.W. Mantulin, B.J. Tromberg, E. Gratton, Two-Photon excited lifetime imaging of autofluorescence in cells during UVA and NIR photostress, J. Microsc. 183, 197-204 (1996)
28. K. König, Multiphoton microscopy in life sciences, J. Microsc. 200, 83-104 (2000)
29. K. König, Clinical multiphoton tomography. J. Biophoton. 1, 13–23 (2008)
30. K. König, A. Uchugonova, Multiphoton Fluorescence Lifetime Imaging at the Dawn of Clinical Application. In: A. Periasamy, R.M. Clegg, eds., FLIM Microscopy in Biology and Medicine. CRC Press 2009
31. J.R. Lakowicz, Principles of Fluorescence Spectroscopy, 3rd edn., Springer (2006)
32. M. D. Lesoine, S. Bose, J. W. Petrich, E. A. Smith,Supercontinuum Stimulated Emission Depletion Fluorescence Lifetime Imaging. J. Phy. Chem. B, 116, 7821-7826 (2012)
33. B. R. Masters, P.T.C. So, Multi-photon excitation microscopy and confocal microscopy imaging of in vivo human skin: A comparison. Microscopy and Microanalysis 5, 282-289 (1999)
34. B.R. Masters, P.T.C. So, eds., Handbook of Biomedical Nonlinear Optical Microscopy.Oxford University Press 2008
35. M. Micic, D. Hu, Y.D. Suh, G. Newton, M. Romine, H.P. Lu, Correlated atomic force microscopy and fluorescence lifetime imaging of live bacterial cells, Colloids and Surfaces B, Biointerfaces 34, 205-212 (2004)
36. D.V. O’Connor, D. Phillips, Time-correlated single photon counting, Academic Press, London (1984)
37. J. Pawley (ed.), Handbook of biological confocal microscopy, 3rd edn., Springer (2006)
38. Periasamy, R.M. Clegg, eds., FLIM Microscopy in Biology and Medicine. CRC Press 2009
39. J.P. Philip and K. Carlsson, Theoretical investigation of the signal-to-noise ratio in fluorescence lifetime imaging, J. Opt. Soc. Am. A20, 368-379 (2003)
40. Roberts, M. S., Dancik, Y., Prow, T.W., Thorling, C.A., Li, L., Grice, J.E., Robertson, T.A., König, K., Becker,W. Non-invasive imaging of skin physiology and percutaneous penetration using fluorescence spectral and lifetime imaging with multiphoton and confocal microscopy. European Journal of Pharmaceutics and Biopharmaceutics 77, 469-488 (2011)
41. Rück, Ch. Hülshoff, I. Kinzler, W. Becker, R. Steiner, SLIM: A New Method for Molecular Imaging. Micr. Res. Tech. 70, 403-409 (2007)
42. D. Schweitzer, Metabolic Mapping. In: F.G. Holz, R.F. Spaide (eds), Medical retina, Essential in Opthalmology, Springer (2010)
43. M. C. Skala, K. M. Riching, D. K. Bird, A. Dendron-Fitzpatrick, J. Eickhoff, K. W. Eliceiri, P. J. Keely, N. Ramanujam, In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. J. Biomed. Opt. 12 02401-1 to 10 (2007)
44. H. Studier, W. Becker, Megapixel FLIM. Proc. SPIE 8948 (2014)