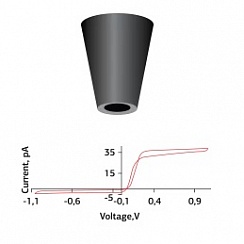
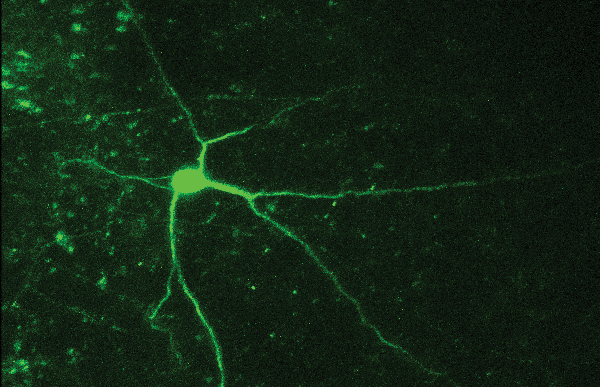
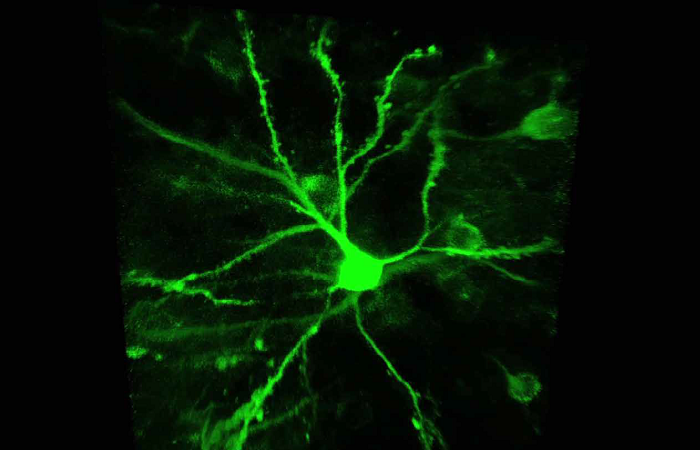
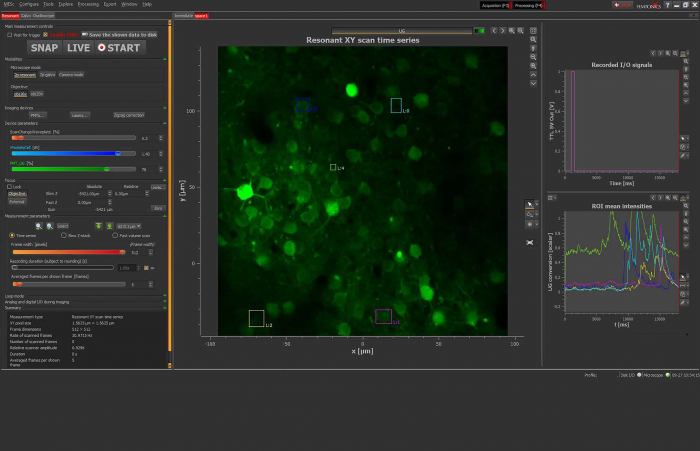
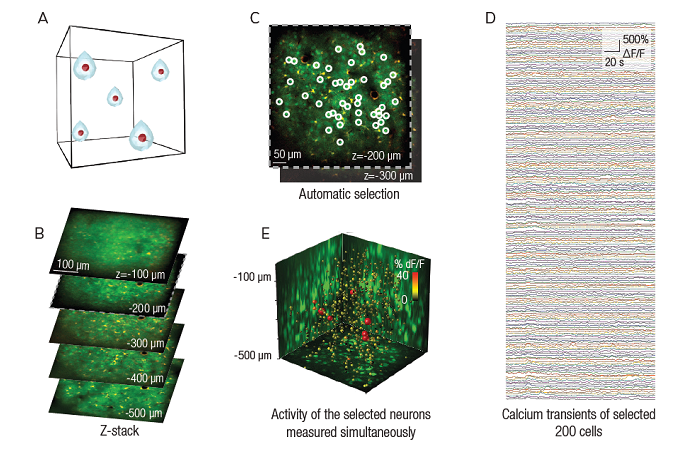
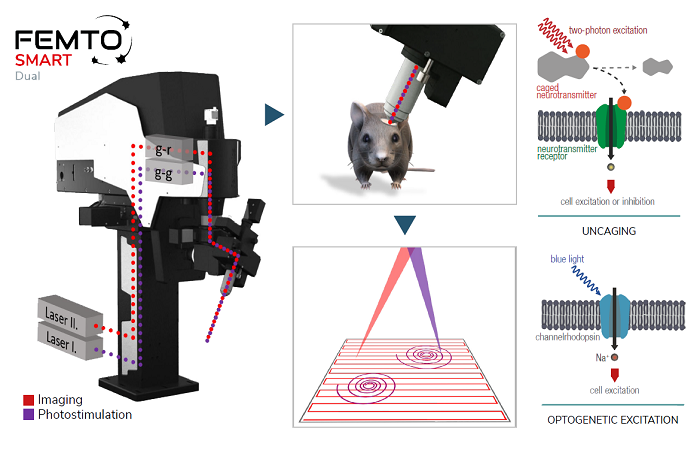
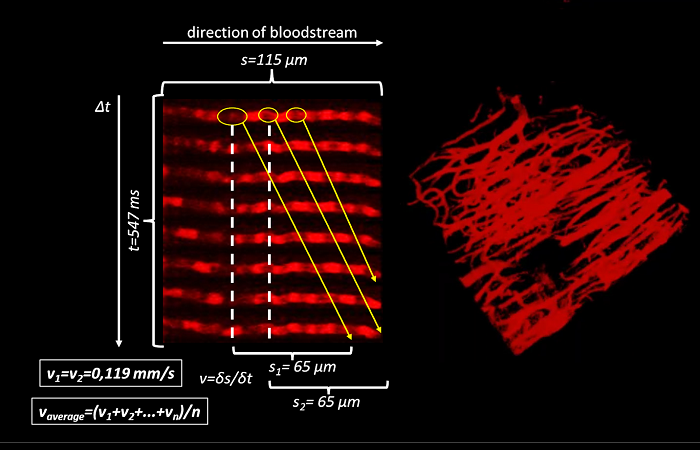
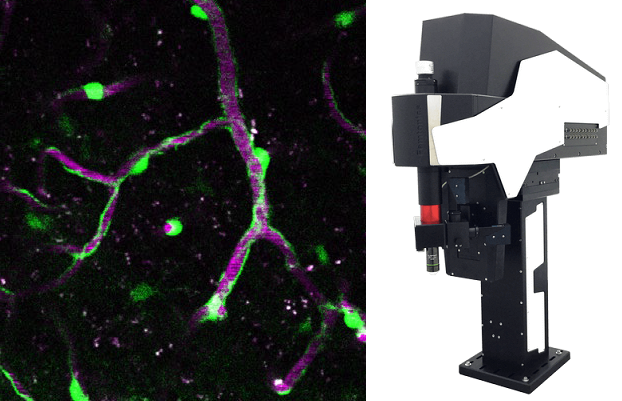
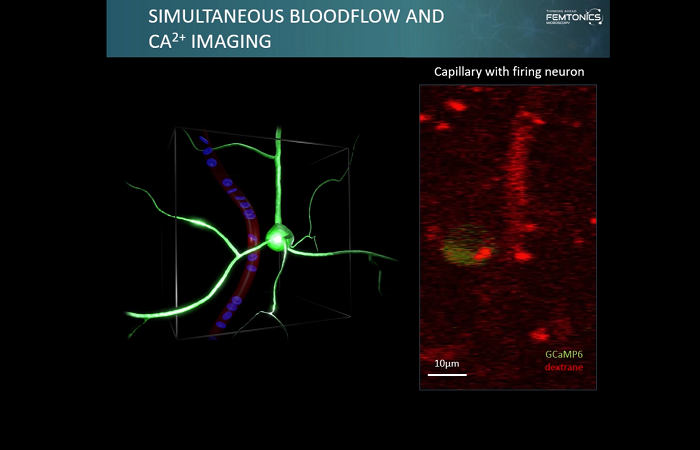
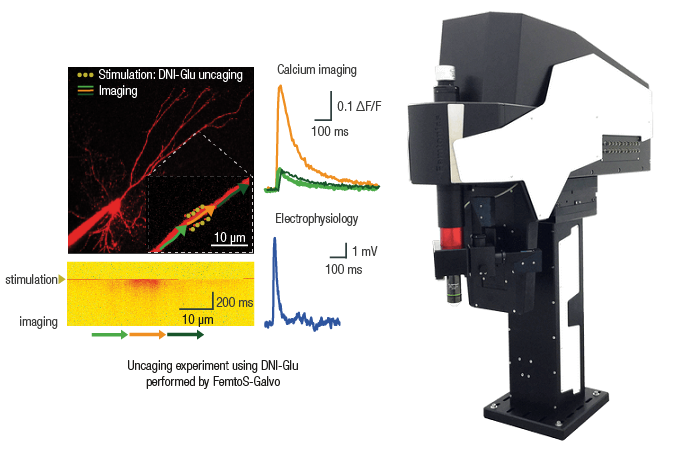
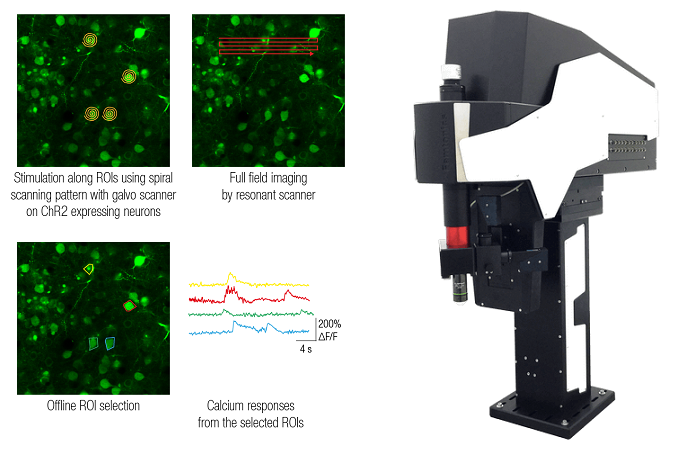
Это можно сделать, приложив к нанопипетке напряжение и/или давление, чтобы высвободить интересующую молекулу. Количество молекул, доставляемых на поверхность, можно контролировать, изменяя напряжение/давление в нанопипетке.
Локальное дозирование с использованием SICM можно использовать для точного и избирательного высвобождения капсаицина в различные дендритные структуры нейронов DRG. Нанопипетку можно расположить над клеткой с наномасштабной точностью, а доставка капсаицина осуществляется напряжением, как показано на графиках. Это было использовано для исследования капсаицин-зависимого притока кальция через рецепторы TRPV18. Концентрация молекул в локальной области зависит от расстояния между кончиком нанопипетки и поверхностью. Таким образом, преимуществом SICM является то, что расстояние до образца можно контролировать с помощью порога проводимости.
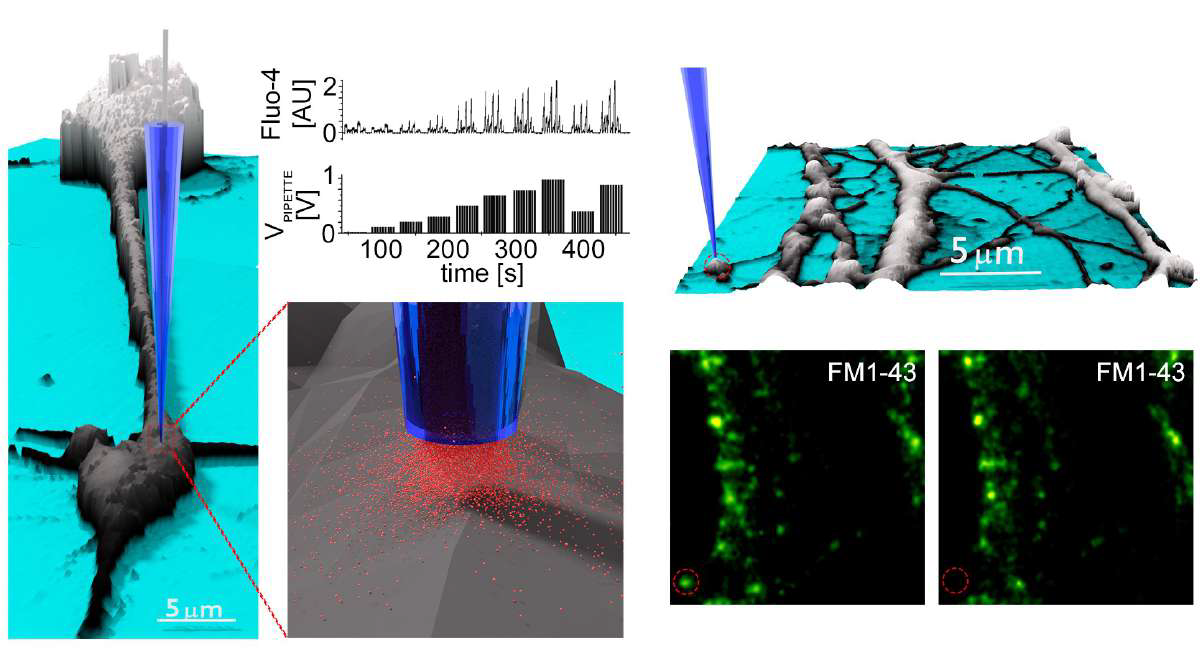
Локальное дозирование KCL вызывает высвобождение флуоресцентно меченных везикул FM1-43 из синаптических бутонов гиппокампа (отмечено красным кружком). Быстрый режим многократной доставки этой системы хорошо подходит для фармакологических экспериментов с высокой производительностью и позволяет за считанные минуты получить сотни кривых доза-эффект на поверхности клетки.
Местное дозирование под давлением
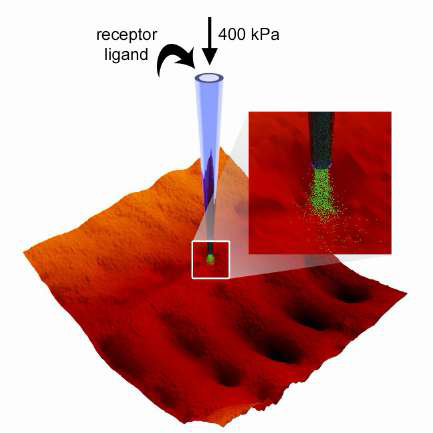
Локальное дозирование с использованием SICM также может быть достигнуто с помощью давления для осаждения молекул на поверхность клетки высоколокализованным образом. Это было сделано с целью депонирования лигандов рецепторов в различных областях мембраны кардиомиоцитов с целью изучения пространственной локализации β1- и β2-адренорецепторов и их перераспределения при развитии сердечной недостаточности [9]. Очень маленький размер кончика нанопипетки позволяет осуществлять высоколокализованное осаждение молекул на поверхность клетки и, следовательно, локализованную и селективную стимуляцию интересующего рецептора.
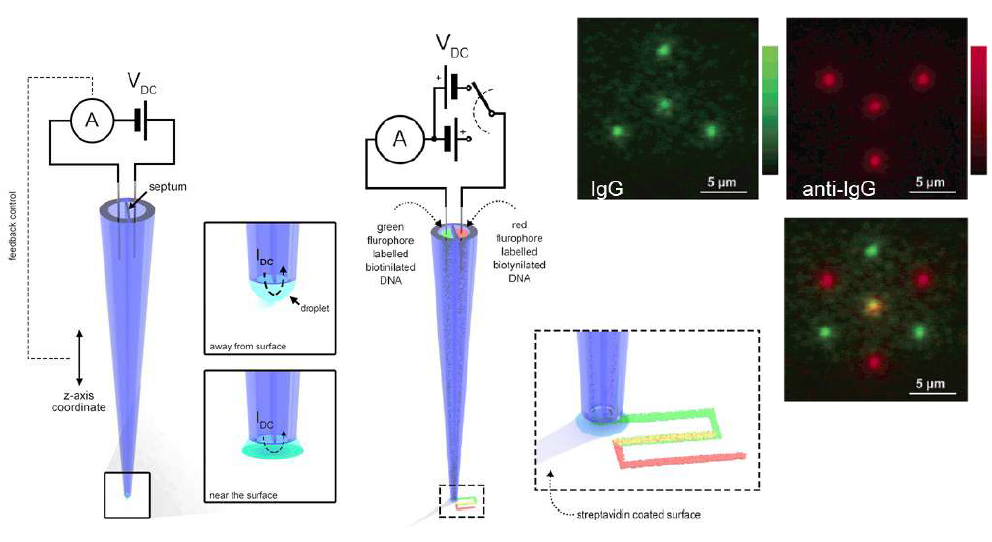
Осаждение биомолекул
SICM можно использовать для нанесения на поверхность биомолекул, таких как ДНК и антитела. Двуствольные пипетки позволяют независимо наносить на поверхность два разных вещества. Напряжение, приложенное между двумя электродами в каждом из цилиндров нанопипетки, создает ионный ток через каплю, которая образуется на кончике. Это позволяет контролировать ионный ток и осаждение биомолекул без необходимости помещать образец в ванну с проводящим раствором. Флуоресцентно меченные антитела были нанесены на стеклянную поверхность, покрытую PEI [10].
Литература
[8] Babakinejad, B. et al. (2013) ‘Local delivery of molecules from a nanopipette for quantitative receptor mapping on live cells’, Analytical Chemistry, 85(19), pp. 9333–9342. doi: 10.1021/ac4021769.
[9] Nikolaev, V. O. et al. (2010) ‘β2-adrenergic receptor redistribution in heart failure changes cAMP compartmentation’, Science, 327(5973), pp. 1653–1657. doi: 10.1126/science.1185988.
[10] Rodolfa, K. T. et al. (2005) ‘Two-component graded deposition of biomolecules with a double-barreled nanopipette’, Angewandte Chemie - International Edition, 44(42), pp. 6854–6859. doi: 10.1002/anie.200502338.