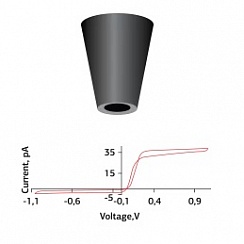
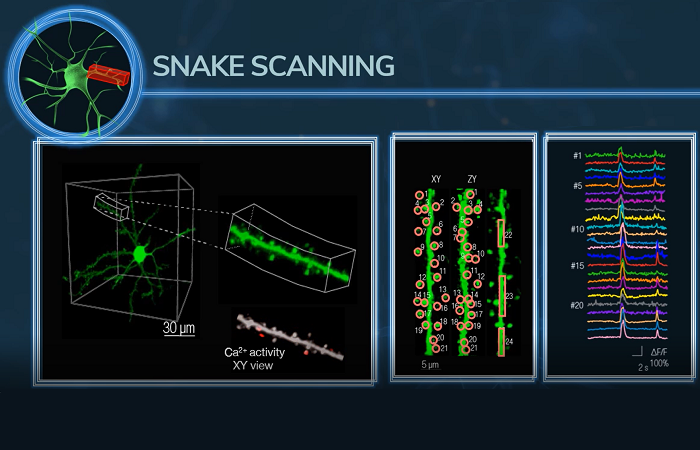
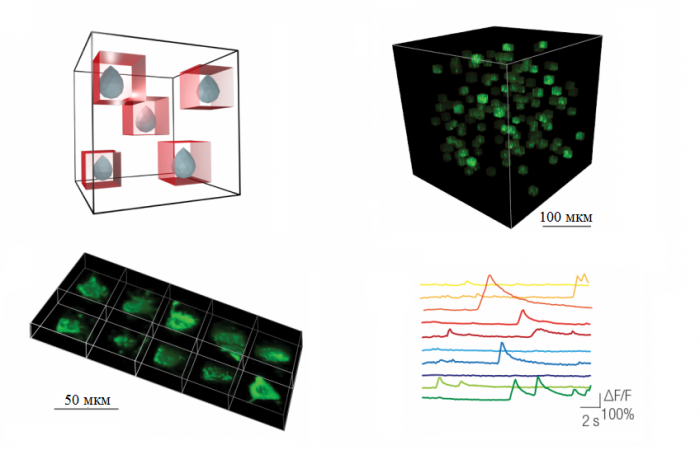
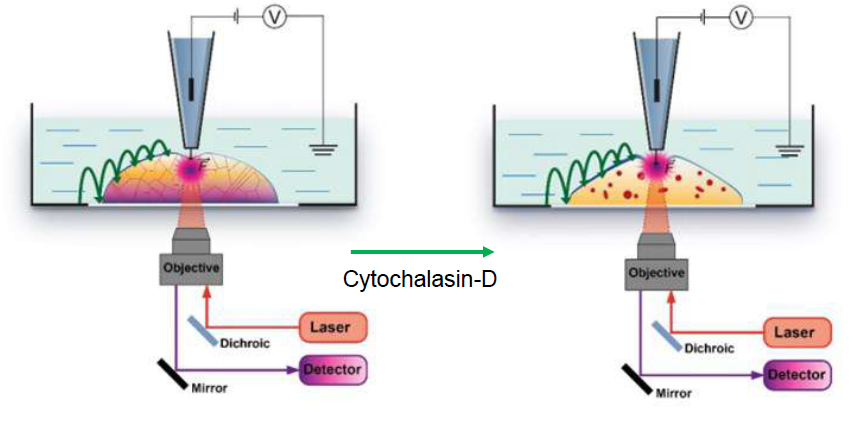
В SICM ионный ток используется для управления вертикальным положением нанопипетки, а это означает, что поверхность клетки остается на одинаковом расстоянии от кончика нанопипетки во время сканирования. В SICMFCM лазер фокусируется чуть ниже кончика нанопипетки, что означает, что флуоресцентные данные пространственно совпадают с топографическим изображением.
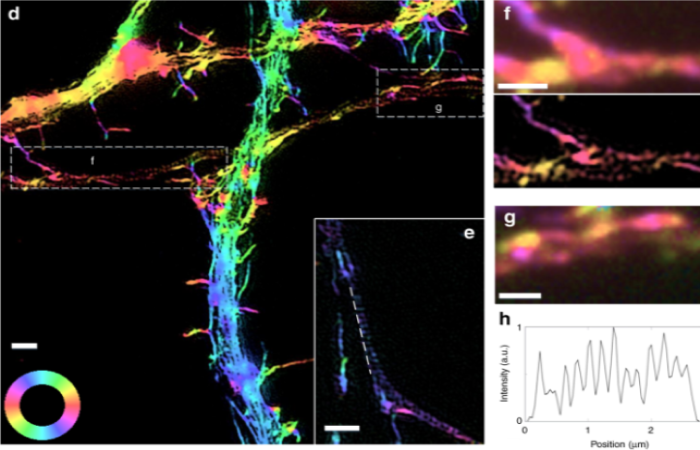
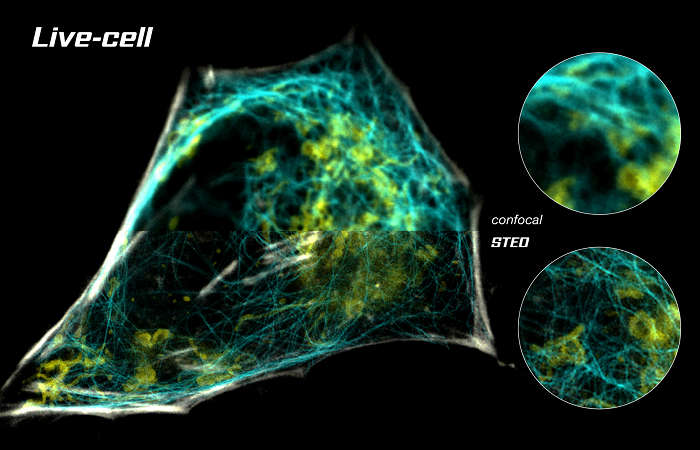
SICM-FCM можно использовать для визуализации внутренних изменений цитоскелета клетки в режиме реального времени. Поскольку клетки не требуют фиксации, можно периодически делать конфокальные изображения одной и той же клетки, чтобы продемонстрировать реструктуризацию цитоскелета из-за добавления лекарств [3].
SICM-FCM похож на корреляционную световую и электронную микроскопию (CLEM), поскольку создает пространственно выровненные изображения поверхности и флуоресценции. Однако основным преимуществом SICMFCM перед CLEM является то, что это метод визуализации в реальном времени, который позволяет отслеживать динамические морфологические изменения на поверхности клеток, такие как поглощение наночастиц и вирусов [4].
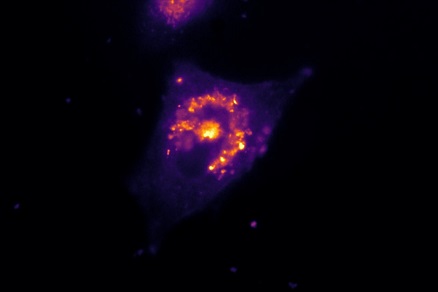
Визуализация наночастиц

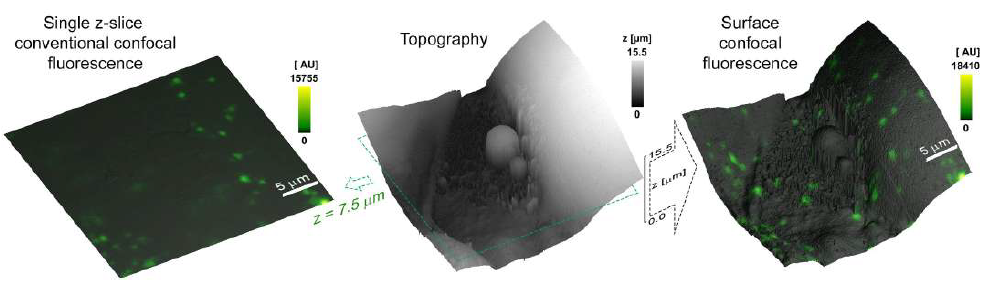
Пространственно выровненная топография, наклон и конфокальные изображения поверхности позволяют точно локализовать наночастицы на поверхности клеточной мембраны. Это можно увидеть на конфокальных изображениях поверхности с высоким разрешением 200-нм красных флуоресцентных наночастиц на поверхности эпителиальных клеток легких. Ряд выступов на топографическом изображении совмещены с красными пятнами флуоресценции, указывающими на наличие наночастиц на поверхности. Однако существуют флуоресцентные пятна (стрелки), которые не соответствуют топографическому выступу на поверхности клетки, что указывает на то, что наночастица уже интернализована. Эту информацию невозможно получить только по флуоресцентному изображению [5]. В то же время не все топографические выступы с размерами, близкими к сфере 200 нм, колокализуются с пятнами флуоресценции, что указывает на то, что топография сама по себе также не может служить однозначным доказательством присутствия наночастиц на поверхности.
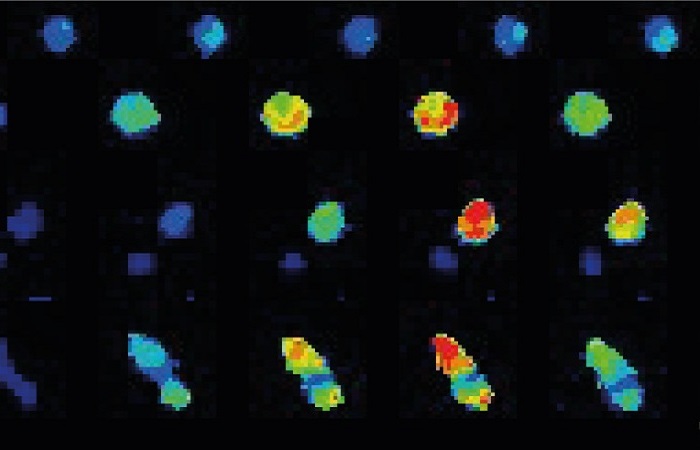
Секреция инсулина
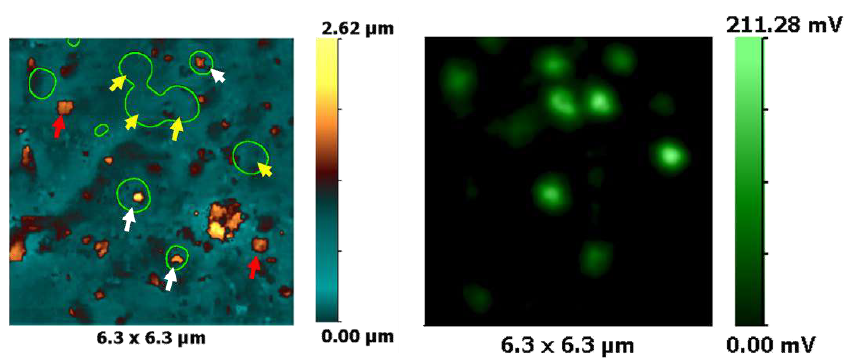
SICM и флуоресцентная конфокальная коррелятивная живая визуализация секреции инсулина на уровне отдельных гранул в клетках инсулиномы крысы (INS-1E), меченных NPY-Venus. Показаны высвободившиеся (красные стрелки), вновь высвободившиеся (белые стрелки) гранулы инсулина и везикулы с плотным ядром, пристыкованные к мембране (желтые стрелки). Также показаны флуоресцентно меченные везикулы с плотным ядром инсулина [4]. Сочетание SICM и флуоресцентной микроскопии представляет собой новый метод, который позволяет напрямую, без использования меток, визуализировать высвобождение везикул с плотным ядром на поверхности клетки.
Литература
[3] - Kolmogorov, V. S. et al. (2021) ‘Mapping mechanical properties of living cells at nanoscale using intrinsic nanopipette–sample force interactions’, Nanoscale, 13(13), pp. 6558–6568. doi: 10.1039/D0NR08349F.
[4] - Bednarska, J. et al. (2020) ‘Release of insulin granules by simultaneous, high-speed correlative SICM-FCM’, Journal of Microscopy. doi:10.1111/jmi.12972.
[5] - Shevchuk, A. I. et al. (2008) ‘Imaging single virus particles on the surface of cell membranes by high-resolution scanning surface confocal microscopy’, Biophysical Journal. Elsevier, 94(10), pp. 4089–4094. doi: 10.1529/biophysj.107.112524.