Поддержание целостности генома напрямую зависит от пространственно-временного рекрутирования и регуляции белков репарации в местах повреждения ДНК. Изменение этого сложного биологического пути может вызвать мутации или преждевременную гибель клеток. Мониторинг этого явления в режиме реального времени можно осуществлять с помощью метода, называемого лазерным микрооблучением высокоэнергетическими фотонами, сфокусированными на желаемой области, чтобы вызвать повреждения. Такой подход стал мощным инструментом для изучения восстановления ДНК после лазерного повреждения.
Биологический контекст
Целостность геномной ДНК постоянно подвергается воздействию генотоксических факторов, таких как радиация, химические вещества, реактивные продукты клеточного метаболизма или мутагены окружающей среды. Одним из них является ультрафиолетовый свет (УФ), который может вызывать 100 000 повреждений ДНК в час на каждую подвергающуюся воздействию клетку (Jackson & Bartek, 2009). Все они могут привести к одно- или двухцепочечному разрыву ДНК. Если они останутся нерепарированными, эти патологические явления могут вызвать мутации и впоследствии рак и/или гибель клеток. Чтобы предотвратить эти изменения, клетки разработали эффективный инструмент для восстановления ДНК и восстановления ее целостности как можно быстрее.
Лазерное микрооблучение может индуцировать искусственные повреждения ДНК для оценки рекрутирования большого набора ферментов репарации (рис. 1). Впервые использованный в 1980 г. (Cremer et al., 1980), в настоящее время он стал ключевым методом изучения участия репарации ДНК (Suzuki et al., 2011; Zentout et al., 2021; Kong et al., 2021).

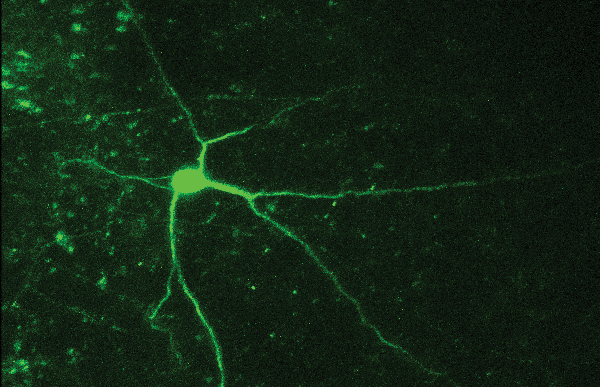
Рисунок 1: Реакция на повреждение ДНК
Клетки постоянно сталкиваются с экзогенными (химические вещества, УФ-свет, ионизирующее излучение) и эндогенными (АФК, …) агентами, которые могут привести к повреждению ДНК. Когда ДНК повреждена, для восстановления этого изменения привлекается большая группа белков. Неустраненные повреждения могут нарушить целостность ДНК и привести к преждевременной гибели клеток, раку или мутациям.
Микрооблучение с помощью Inscoper scanFRAP
Inscoper scanFRAP — это комплексное решение для фотоманипуляции и оптогенетики. Продукт состоит из программного и аппаратного сегментов, совместимых с передовыми видеомикроскопами, используемыми в науках о жизни. Включая специально разработанный электронный блок для управления штативом микроскопа и сторонними устройствами, Inscoper scanFRAP обеспечивает новый пользовательский интерфейс для приложений фотоманипуляции с улучшенными техническими характеристиками, полной системной интеграцией и простотой использования.
Это современное решения позволяют добавлять эксперименты по фотоманипуляции и оптогенетике в обычные последовательности сбора данных, обеспечивая полный и плавный рабочий процесс обработки изображений, совместимый с другими методами обработки изображений, также реализованными в системе. Ядро технологии Inscoper устраняет любую задержку программного обеспечения при управлении всей системой микроскопии. Это увеличивает временное разрешение по сравнению с традиционными подходами, что является основным преимуществом для приложений визуализации живых клеток (рис. 2).
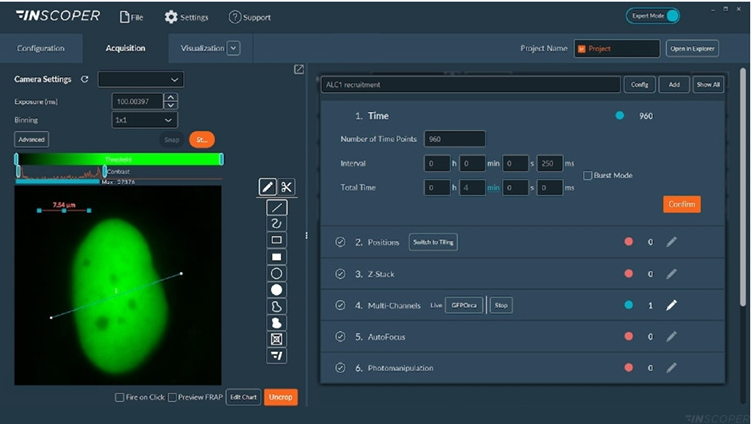
Рисунок 2: Интерфейс программного обеспечения Inscoper
На рисунке 2 представлен обзор программного обеспечения Inscoper, используемого для управления последовательностью сбора данных с многомерными параметрами, включая замедленную съемку, многопозиционное и/или мозаичную регистрацию, Z-стек, многоканальность и фотоманипуляцию для микрооблучения, а также приложения FRAP. Все эти параметры можно полностью настроить под нужды Вашего эксперимента.
Основанная на технологии гальванометрического зеркала, система Inscoper scanFRAP представляет собой микроскопическое решение для приложений фотоманипуляции, включая FRAP, фотоактивацию или микрооблучение. В статье основное внимание уделяется применению микрооблучения. Исследователи имеют полный контроль над всеми настройками лазера. Они могут полностью персонализировать и оптимизировать области микрооблучения, модулируя интересующую область (ROI) в режиме реального времени в пользовательском интерфейсе программного обеспечения. Более высокая скорость сбора данных позволяет отслеживать биологические явления после микрооблучения с очень высоким временным разрешением, например рекрутирование репарационных белков после повреждения, вызванного лазером.
Эксперименты по микрооблучению
Объектив
Мы хотим охарактеризовать рекрутирование белка ALC1 (хромодомен-хеликаза-ДНК-связывающий белок 1-подобный) после повреждения ДНК, вызванного лазером. Этот белок участвует в распаковке ДНК, что позволяет рекрутировать другие ферменты репарации (Sellou et al, 2016).
Материалы
Был использован микроскоп Nikon Ti2 Eclipse (Nikon, Токио, Япония) с масляным иммерсионным объективом Plan Apo λ 60x 1,4 NA (MRD01605; Nikon). Для этих экспериментов использовалась цифровая камера CMOS ORCA-Fusion BT (C15440-20UP; Hamamatsu Photonics, Хамамацу, Япония), а световой двигатель был от Lumencor (SpectraX; Lumencor, Бивертон, США). Микрооблучение проводили с помощью Inscoper scanFRAP (INSCOPER, Cesson-Sévigné, Франция) с лазерным источником 405 нм (L6Cc; Oxxius, Lannion, Франция).
Методы
Клетки U2OS трансфицировали для сверхэкспрессии ALC1, слитого с GFP (зеленый флуоресцентный белок), в результате чего был получен белок ALC1-GFP (GenBank AF537213.1,A). Ядра были помечены с использованием Hoechst 33342 (H3570; ThermoFisher Scientific, Уолтем, США) перед визуализацией. В этом эксперименте микрооблучение индуцировали с использованием лазера с длиной волны 405 нм (интенсивность 100% в течение 1 секунды), чтобы вызвать повреждение ДНК и рекрутирование белка ALC1-GFP в поврежденной области. Это измерение позволяет охарактеризовать динамику белка ALC1 после лазерного повреждения ДНК. Рекрутирование ALC1-GFP контролировали с использованием возбуждения 488 нм (время экспозиции: 100 мс и частота кадров: 4 кадра в секунду).
Результаты
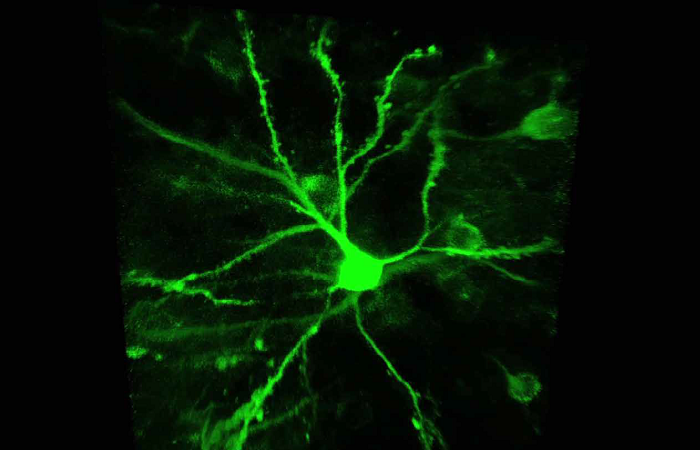
Лазерное микрооблучение представляет собой мощный инструмент для мониторинга репарации ДНК с высоким временным и пространственным разрешением. Повреждения ДНК индуцировали в определенной ROI (области интереса), предварительно определенной с помощью программного обеспечения Inscoper. Во время сбора данных можно было наблюдать прогрессивное пополнение белка ALC1-GFP по всей длине области интереса (рис. 3А). Затем измеряли среднюю интенсивность флуоресцентного сигнала на поврежденном участке. Сигнал от неизмененной области интереса также измеряли в качестве контроля. В области облучения наблюдалось быстрое увеличение сигнала, который оставался стабильным не менее чем 10 секунд (рис. 3В). Напротив, после фотоманипуляции интенсивность контрольной области интереса несколько уменьшилась. Накопление ALC1-GFP также может характеризоваться шириной полосы (рис. 3C).
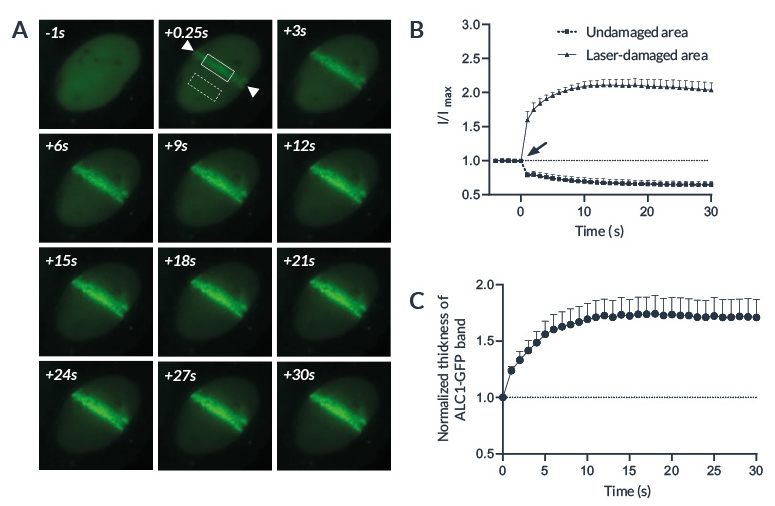
Рисунок 3: Рекрутирование ALC1 после лазерного повреждения ДНК.
На рисунке 3 представлено: (A) Репрезентативное изображение, показывающее накопление ALC1-GFP в местах лазерного повреждения ДНК в клетках U2OS. Область между стрелками была повреждена лазером с длиной волны 405 нм. Сплошные и пунктирные прямоугольники представляют соответственно поврежденную лазером и контрольную зону. (B) Количественное накопление ALC1-GFP после микрооблучения (стрелка) на поврежденных лазером (кружки) и неповрежденных (квадраты) участках. (C) Нормализованная толщина полосы ALC1-GFP в облученной области после повреждения ДНК, индуцированного лазером.
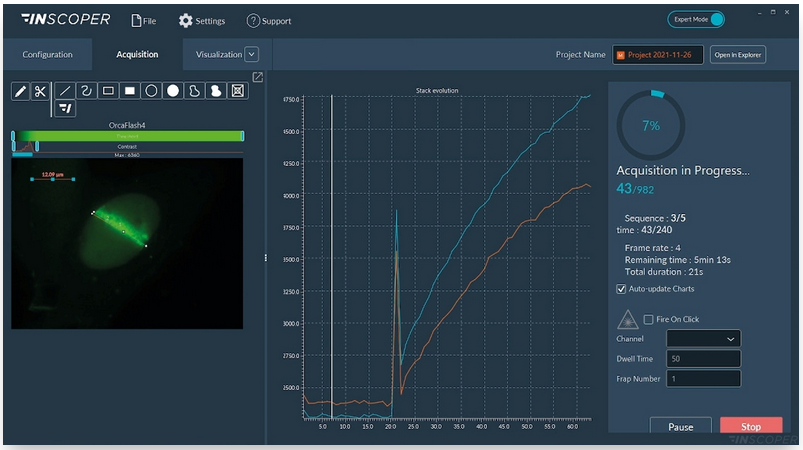
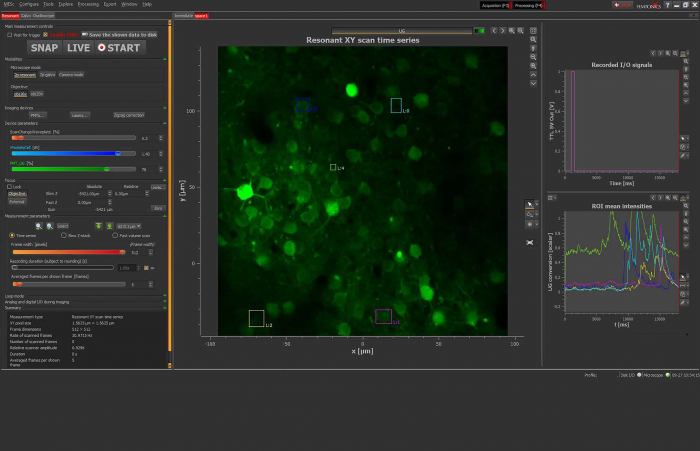
Рис. 4. Вид интерфейса программного обеспечения Inscoper во время сбора данных FRAP.
Как видно на рисунке 4 сбор данных отслеживается в режиме реального времени с помощью изображений или графиков. Функцию «Fire-on-Click» (нижняя правая часть интерфейса) можно активировать в любой момент, чтобы добавить новую область интереса к фотообесцвечиванию во время сбора данных.
Заключение
Лазерное микрооблучение живых клеток помогает изучать клеточный ответ на повреждения ДНК. Использование решения Inscoper scanFRAP позволяет отслеживать в режиме реального времени рекрутирование широкого спектра белков репарации ДНК с высоким пространственно-временным разрешением. Также может быть полезно оценить влияние лекарств на поддержание целостности ДНК. Лазерное микрооблучение можно комбинировать с другими подходами в микроскопии, чтобы лучше охарактеризовать биологические пути, участвующие в репарации ДНК. Например, его можно сочетать с FLIM (микроскопия флуоресцентной визуализации) для оценки клеточных метаболических изменений (Murata et al., 2019) или FRET (флуоресцентно-резонансный перенос энергии) для характеристики кинетики белковых взаимодействий (Lou et al., 2019).