Микроскопы являются важнейшим инструментом для современных приложений в области естественных наук: от медицинской диагностики (например, определение источника инфекции или степени тяжести опухоли) до анализа продуктов питания. При таком спросе неудивительно, что в последнее десятилетие произошел бум в развитии технологий микроскопии, позволяющих исследователям преодолевать дифракционный предел (предел Аббе) и получать более глубокое понимание сложных процессов. Однако простоту использования и доступность высококлассных технологий трудно найти в рамках одного продукта на рынке.
С развитием систем микроскопии происходило одновременное развитие техники микроскопии. Первые методы микроскопии были основаны на микроскопии в проходящем свете. Дополнительные методы, которые очень ценны для современных специалистов по микроскопии, — это широкопольная флуоресцентная микроскопия и конфокальная микроскопия. Кроме того, восстановление и обработка изображений путем переназначения фотонов является существенным фактором при обработке изображений после их получения. Таким образом, программное обеспечение для деконволюции стало необходимым инструментом для обработки изображений после получения.

Рисунок 1 - Конфокальный снимок Stentor pyriformis, полученный с помощью Andor Dragonfly. 253 оптических среза, снятых с помощью 40-кратного (1,1 NA) водного объектива с 40 мкм pinhole на Dragonfly
Микроскопия в проходящем свете
При микроскопии в проходящем свете свет проходит через образец, собственно поэтому метод так и назван. Самой простой техникой является светлопольная (метод светлого поля). Этот метод полезен для получения изображений толстых тканей или тканей, окрашенных гистологическими красителями, такими как гематоксилин и эозин, для обеспечения контрастности и детализации изображения. Однако яркое поле не идеально для визуализации более тонких и неокрашенных образцов. Проблема заключается в том, что структуры внутри клеток не создают достаточного контраста для визуализации нашими глазами. По этой причине были разработаны другие методы микроскопии в проходящем свете.
Фазово-контрастная микроскопия использует кольца фазовых пластин в оптическом тракте, которые создают большую разницу фаз между структурами внутри образцов, что приводит к получению более контрастного изображения. Фазовый контраст является большим усовершенствованием микроскопии в проходящем свете, позволяя наблюдать структуру тонких неокрашенных образцов. Тем не менее, проблемой этой техники является генерируемый яркий ореол ("фазовый ореол"), который может скрыть детали.
Другой метод микроскопии в проходящем свете, обеспечивающий высокий контраст и высокое разрешение, — это ДИК, где ДИК расшифровывается как дифференциальный интерференционный контраст; он имеет сложную и дорогую оптику. ДИК-метод основан на использовании двух поляризаторов: один помещается до попадания света на образец, а другой - после излучения света образцом. Лучи поляризованного света объединяются с небольшим сдвигом; этот сдвиг создает высокий контраст и высокое разрешение изображений в ДИК.
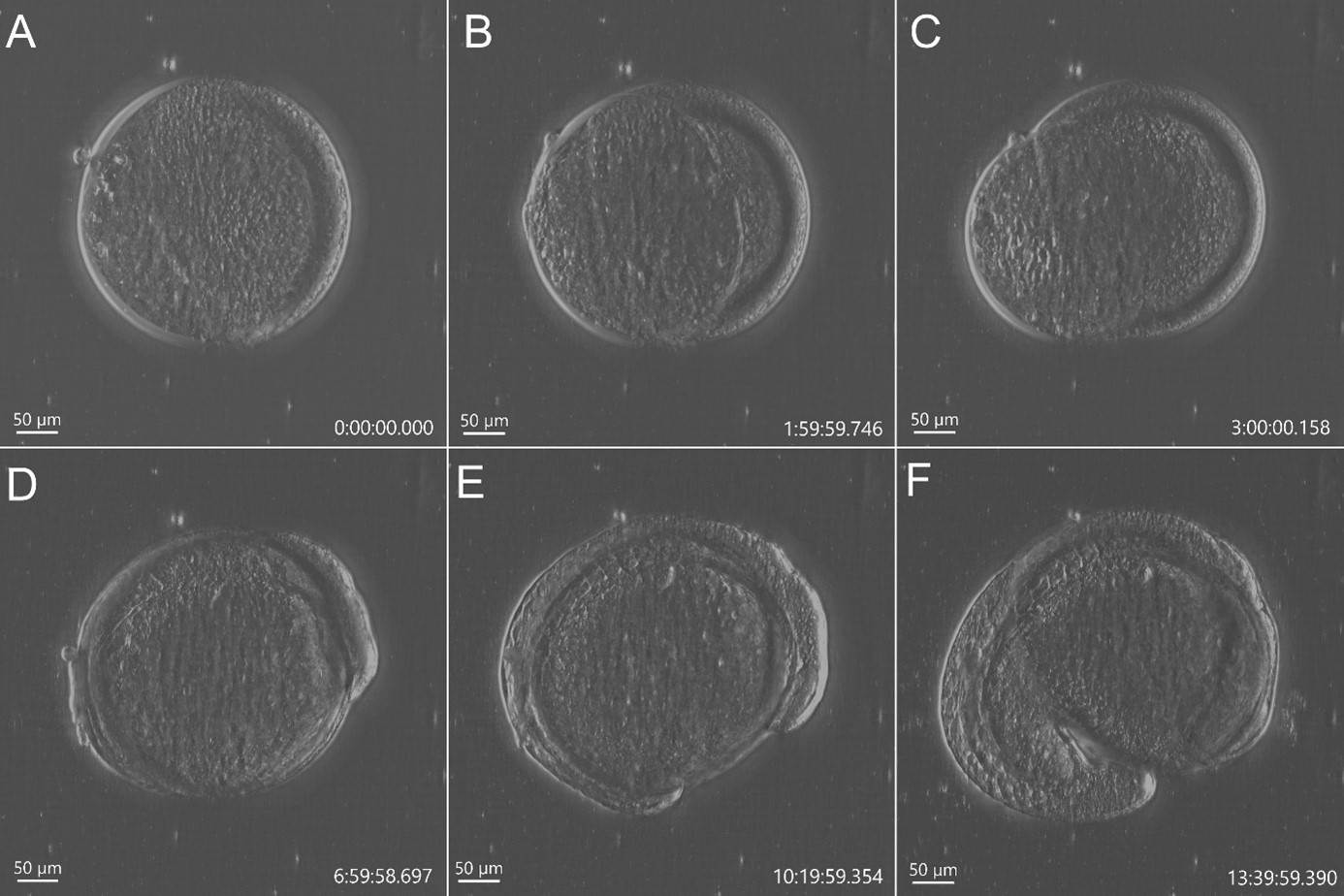
Рисунок 2 - Получение изображений развития данио-рерио без пятен с использованием модальности визуализации DPC от BC43. Однопольное изображение живого эмбриона данио-рерио, полученное с помощью BC43 с использованием 10-кратного объектива (поле зрения 1,84 мм). Визуализация живого эмбриона от стадии купола (A) до 17 ч после оплодотворения (F). Эмбрионы на 50% (B) и 75% (C) эпиболии, 3- (D) (E) сомитной стадии. Изображение эмбриона данио-рерио было получено с помощью объектива 10X. Изображение представляет собой проекцию максимальной интенсивности 35 стеков, охватывающих весь диапазон 700 мкм, и снималось каждые 20 мин в течение 14 часов. Эмбрионы инкубировали при 28ºC.
Недавней разработкой в микроскопии в проходящем свете является DPC - дифференциальный фазовый контраст (рис. 1). Компания Andor усовершенствовала DPC и внедрила его в новый настольный конфокальный микроскоп BC43 (подана заявка на патент).
Принцип работы DPC заключается в том, что градиент фазы может быть извлечен из пары изображений интенсивности, полученных при противоположных углах освещения. Используя математический алгоритм для изображений DPC, можно получить метод количественной реконструкции фазы для дифференциальных фазово-контрастных изображений. (Tian L. & Waller L., 2015).
DPC не требует:
- специальные объективы (например, объективы для фазового контраста),
- поляризационной оптики (как в ДИК),
- и, его можно использовать для получения изображений образцов с двойным лучепреломлением (Tian L. et al., 2014).
Кроме того, DPC обеспечивает постоянный доступ к образцу во всех областях, все время (не зависит от подстройки углов или регулировки поляризаторов). В отличие от ДИК, изображения DPC могут быть получены через пластиковую посуду, что практично и часто необходимо для многочисленных приложений биологической визуализации. DPC обеспечивает высокую контрастность и высокое разрешение изображений даже в неокрашенных тонких образцах.
В заключение следует отметить, что DPC - это простой в использовании недорогой метод микроскопии в проходящем свете, позволяющий достичь больших углов освещения и избежать трудностей, связанных с механическим сканированием. Для микроскопии в проходящем свете DPC сочетает в себе лучшее из методов визуализации фазового контраста и ДИК. Поэтому DPC является превосходным методом визуализации без меток, имеющим очевидное применение в визуализации живых образцов.
В микроскопах Andor Dragonfly и BC43 доступны технологии работы в проходящем свете. Новый настольный конфокальный микроскоп BC43 также выгодно отличается тем, что в него органично интегрирована система DPC. Пожалуйста, ознакомьтесь с информацией о BC43, чтобы получить полное представление об этой системе и ее технологиях микроскопии в проходящем свете.
Широкопольная флуоресцентная микроскопия
Широкопольная визуализация характеризуется полным освещением образца и последующим обнаружением всего излучаемого образцом света. С практической точки зрения, при широкопольной визуализации детектор улавливает свет в фокусе и свет вне фокуса.
Широкопольная флуоресцентная микроскопия - это метод оптической микроскопии, который захватывает весь свет от образца (в фокусе и вне фокуса). Однако в основе широкопольной флуоресцентной микроскопии лежит физическое явление флуоресценции:
Явление флуоресценции можно описать следующими шагами:
- Молекула (или молекулярная система) поглощает свет определенной длины волны, т.е. длины волны возбуждения.
- Возбужденный электрон "перепрыгивает" на более высокий энергетический уровень на атомных орбиталях.
- Возбужденный электрон вернется в исходное энергетическое состояние и испустит фотон.
- Испущенный фотон будет иметь большую длину волны (меньшую энергию), чем возбуждающий фотон, т.е. длину волны излучения.
Флуоресценция представляет собой мгновенное явление и прекращает свое существование, как только возбуждающий свет выключается. Широкопольное освещение флуоресценции может быть достигнуто с помощью ртутных и ксеноновых ламповых, светодиодных источников света и, в последнее время, лазерного широкопольного освещения.
Ртутные лампы были первыми источниками света, которые использовались в широкопольной флуоресцентной микроскопии. Одним из преимуществ ртутных ламп является то, что длины волн возбуждения имеют несколько пиков, совпадающих с длинами волн возбуждения многих распространенных флуорофоров, используемых в микроскопии (313, 334, 365, 405, 436, 546 и 579 нм). Однако освещение не является равномерным по всему спектру, что затрудняет количественный анализ образцов. Кроме того, инфракрасные и ближние инфракрасные флуорохромы не возбуждаются этим источником света. Наконец, ртуть - это опасный материал, которого лучше избегать, если это возможно.
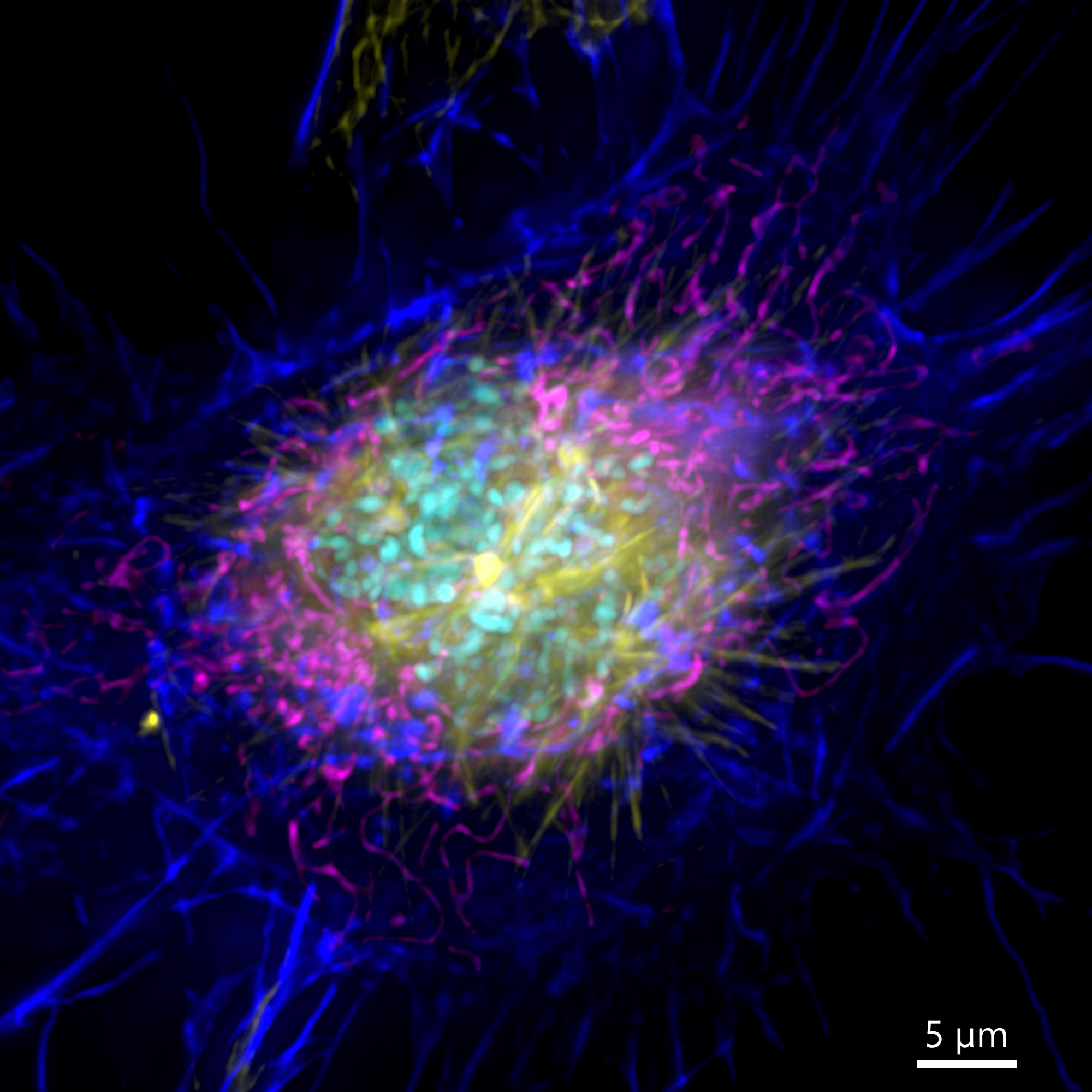
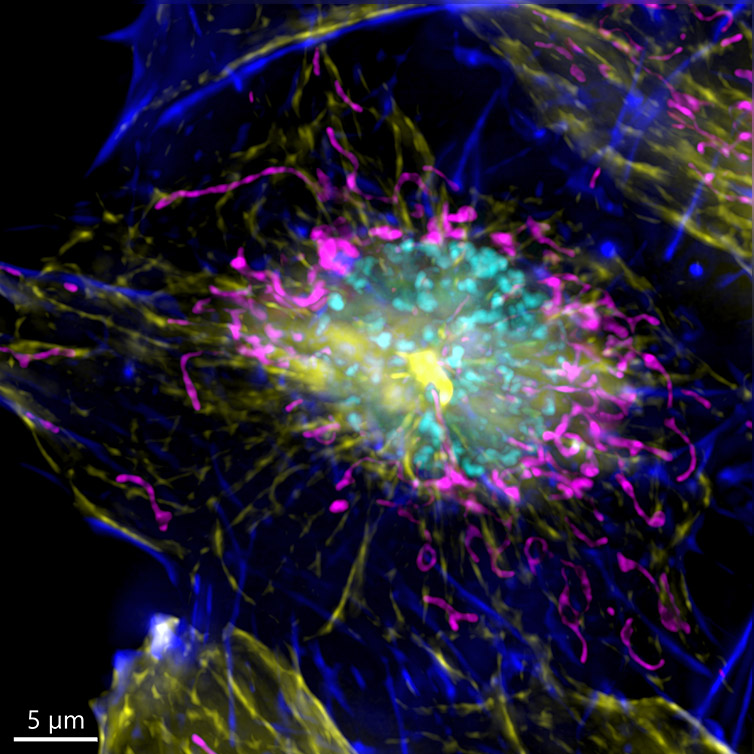
Рисунок 3 - Изображение клетки млекопитающего, полученное в широкопольном режиме с использованием Andor BC43. Изображение показывает широкопольное изображение клетки в профазе. Изображение было подвергнуто деконволюции после получения и представляет собой проекцию максимальной интенсивности 35 стеков в диапазоне 7 мкм. Синий-актин, пурпурный-митохондрии, желтый-микротрубочки, голубой-ДНК.
Ксеноновые лампы имеют гораздо более равномерное освещение в видимом спектре по сравнению с ртутными лампами. Однако обратной стороной является меньшая интенсивность освещения, а также меньшая мощность освещения в ближнем УФ/УФ диапазоне. Это делает использование обычных красителей для окрашивания ДНК, таких как DAPI и Hoechst, затруднительным при использовании данного источника света, так как их излучение слабое. Кроме того, эти источники освещения (ртутные и ксеноновые дуговые лампы) имеют ограниченный срок службы, который уменьшается при частом включении и выключении освещения.
Светодиодные источники света прочно заняли свое место в флуоресцентной микроскопии. Светодиоды стали высокоэффективным источником света с длительным сроком службы, на продолжительность которого не влияет включение и выключение системы. В последние годы светодиодные источники света стали популярными и постепенно вытесняют некогда распространенные ртутные и ксеноновые источники света.
Недавно компания Andor включила в свои конфокальные системы лазерную визуализацию широкого поля. Лазерная широкопольная визуализация обеспечивает резкое и точное возбуждение освещения, что, соответственно, позволяет возбуждать флуорофоры образца. Лазерная широкопольная визуализация может обеспечить как контролируемую очень низкую интенсивность освещения, необходимую для получения изображения высокочувствительного образца, так и гораздо более высокую мощность лазера, необходимую для высокотехнологичных приложений, таких как микроскопия сверхразрешения dSTORM.
Широкопольные микроскопы также имеют фильтры, избирательно пропускающие нужные длины волн излучения к детекторам. В широкопольной микроскопии детекторами являются камеры, как правило, EMCCD или sCMOS. На нашем сайте представлены различные научные камеры, оптимизированные для задач микроскопии.
В целом, широкопольные системы захватывают весь свет, излучаемый образцом, и не предполагают оптического расслоения. По этой причине они не подходят для получения изображений толстых и сильно расходящихся образцов. Однако, поскольку они захватывают весь свет, излучаемый образцом, широкопольные системы полезны для:
- Работы с образцами с высокой фоточувствительностью;
- Визуализации быстротечных событий;
- Тонких образцов;
- Визуализации живых клеток.
Для широкопольной визуализации подходят тонкие малорассеивающие образцы, такие как бактерии, дрожжи, микроводоросли и однослойные клетки. Примеры широкопольной визуализации представлены на рисунке 3.
Решения Andor для конфокальных систем Dragonfly и BC43 обеспечивают лазерную визуализацию широкого поля.
Andor Dragonfly предлагает все технологические возможности широкопольной визуализации. От самых простых рутинных приложений до одновременной двухцветной визуализации и даже высокотехнологичных вариантов, требующих высокой мощности лазера, таких как сверхвысокое разрешение dSTORM.
BC43 — это рабочая лошадка для рутинных исследований и приложений, требующих менее специализированных методов микроскопии. Однако менее требовательный не значит более простой. С помощью BC43 пользователь может получить до 4 различных каналов флуоресцентной визуализации, что означает, что 4 различные структуры могут быть флуоресцентно помечены и обнаружены с помощью BC43.
Конфокальная микроскопия
Широкопольная флуоресцентная микроскопия имеет свои ограничения, и визуализация образцов толщиной более 30 мкм крайне затруднена при широкопольной микроскопии и практически невозможна, если образец имеет толщину более 50 мкм. Проблема в широкопольной флуоресцентной микроскопии заключается в том, что свет, генерируемый вне фокуса, улавливается детектором, и детали теряются. В таких случаях решением является использование оптического расслоения для ограничения освещения только области в фокусе. Оптическое расслоение может быть достигнуто с помощью конфокальных микроскопов.
Конфокальные микроскопы освещают образец путем сканирования образца с помощью одного или нескольких сфокусированных световых пучков и захватывают только сфокусированный свет от оптического участка, на который поступает изображение. Существует два различных типа конфокальных микроскопов: лазерные сканирующие конфокальные микроскопы (LSCM) и конфокальные микроскопы с вращающимся диском. Обе системы конфокальной визуализации обеспечивают получение оптического среза через образец, но технология, лежащая в основе этих двух типов приборов, принципиально отличается.
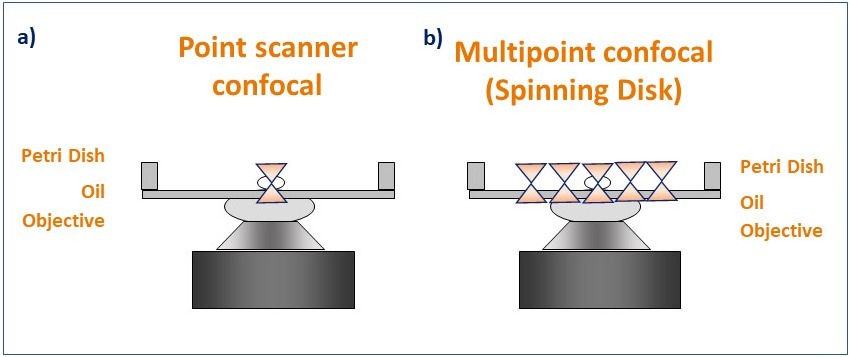
Рисунок 4. Принципиальная схема, иллюстрирующая схему освещения для микроскопии с точечным сканером и вращающимся диском. Конфокальная микроскопия с точечным сканером (a) фокусирует одну точку лазерного света через небольшое отверстие (пинхол) и последовательно сканирует образец точка за точкой. Конфокальная микроскопия с вращающимся диском (b) освещает образец с помощью вращающейся схемы из тысяч отверстий для полного одновременного конфокального освещения.
Лазерные сканирующие конфокальные микроскопы (также называемые конфокальными микроскопами с точечным сканированием) сканируют образец с помощью небольшого пятна лазерного луча высокой интенсивности. Пятно фокусируется с помощью объектива и перемещается в боковом направлении вдоль области сканирования для сканирования образца. Из излучаемого света только сфокусированный участок Z пройдет через единственное отверстие, чтобы создать оптическое сечение (на этом единственном пятне). После прохождения через отверстие излучаемый свет регистрируется фотоумножителем (PMT). Результирующее изображение представляет собой сумму всех одиночных точек, зарегистрированных в зоне сканирования.
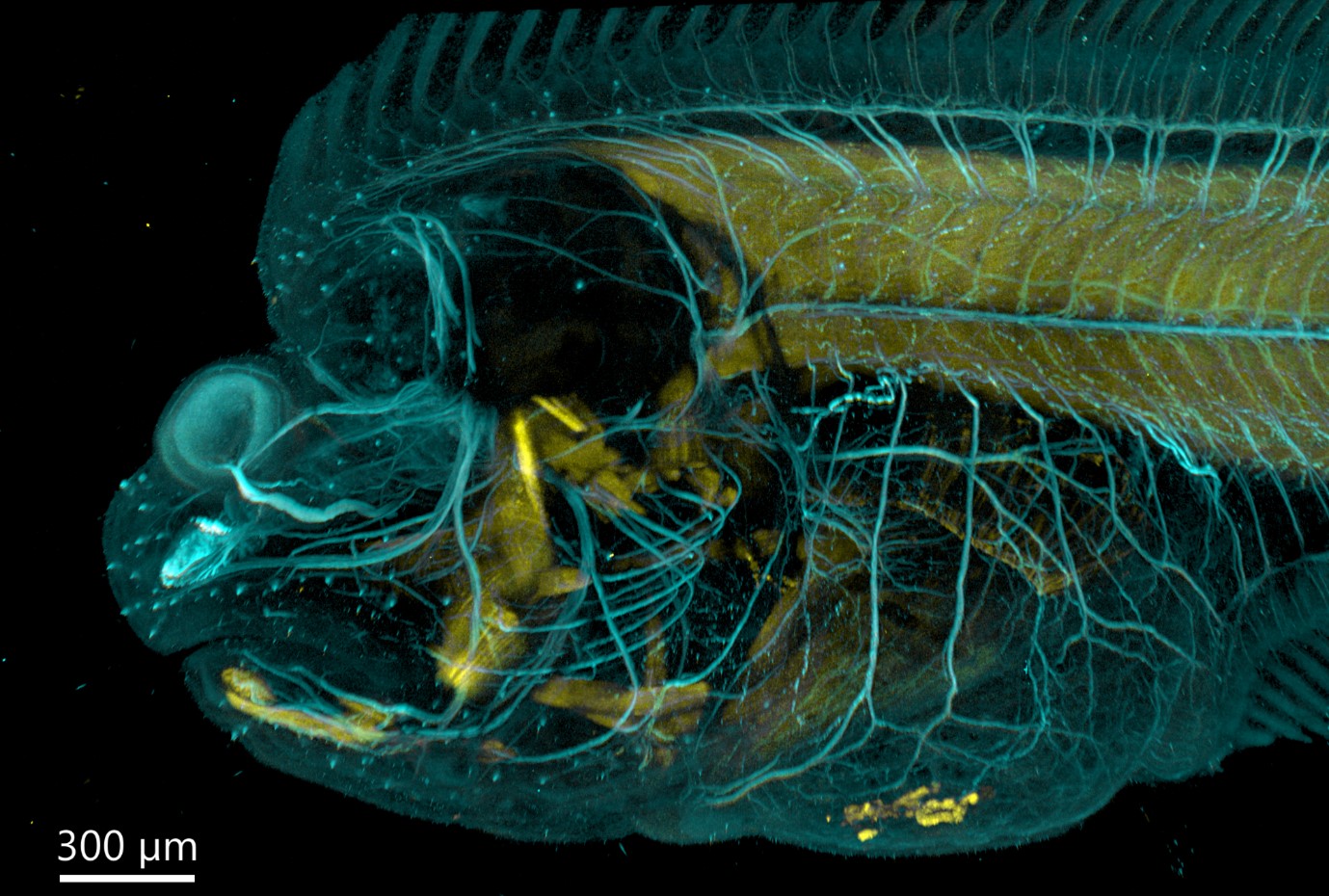
Рисунок 5 - Изображение камбалы, полученное с помощью BC43 с использованием параметра конфокальной съемки. Изображение получено с помощью Andor BC 43 с использованием многократного получения и монтажа плиток. Для составления изображения было получено 6 фрагментов, охватывающих диапазон 554 мкм. Изображение обработано с помощью Imaris
Ограничения лазерных сканирующих конфокальных микроскопов включают динамический диапазон получаемого изображения и скорость получения (поскольку образец сканируется точечно). Квантовая эффективность ФЭУ составляет 45%, что означает, что из 100 возбужденных фотонов только 45 будут преобразованы в электроны и зарегистрированы как сигнал, остальные будут потеряны. Из-за низкой скорости сканирования и низкой квантовой эффективности детекторов лазерные сканирующие конфокальные системы не подходят для визуализации живых объектов.
Важно отметить, что из-за медленной скорости получения точечных сканеров при визуализации больших образцов приходится идти на компромисс с разрешением, что приводит к получению изображений с разрешением ниже критерия Найквиста. Более того, даже при компромиссном разрешении скорость получения изображений чрезвычайно низка по сравнению с оптимизированной многоточечной системой с вращающимся диском, такой как конфокальные системы Andor.
Конфокальные микроскопы с вращающимся диском, также известные как многоточечные конфокальные микроскопы, сканируют образец с помощью диска, содержащего множество отверстий. Диск с отверстиями вращается с высокой скоростью, и для получения изображения требуется менее одного полного оборота диска. В результате система может передавать оптические секционированные конфокальные изображения со скоростью 44 кадра в секунду (Andor BC43) и 400 кадров в секунду (ANDOR Dragonfly).
Системы вращающихся дисков Andor имеют встроенную двойную микролинзовую систему, в которой параллельные лучи лазерного света фокусируются через массив микролинз, а микролинзы синхронизированы с отверстиями в вращающемся диске. Эта двойная система обеспечивает более эффективный захват света, снижая фоновый шум в изображении. В результате снижается мощность лазера, необходимая для получения превосходного конфокального изображения.
В конфокальных микроскопах с вращающимся диском используются детекторы на основе камер. Детекторы на основе камер обеспечивают квантовую эффективность, которая в 2 раза выше, чем квантовая эффективность фотоэлектронных умножителей (ФЭУ). С практической точки зрения, для получения одинакового соотношения сигнал/шум изображения в лазерном сканирующем микроскопе, образец необходимо освещать в 2 раза большей мощностью лазера по сравнению с эквивалентной системой, использующей детектор на основе камеры. Обратите внимание, что увеличение мощности лазера при освещении образца приведет к большему обесцвечиванию образца и фототоксичности.
Хотя первое поколение конфокальных микроскопов с вращающимся диском обеспечивало оптическое разделение, оно не позволяло проводить визуализацию глубоко внутри клеток и тканей, поскольку изображения страдали от перекрестных помех от пинхоллов на глубине около 30 мкм. Однако в Andor Dragonfly и Andor BC43 оптимизированы расстояние между отверстиями и их размер, что позволяет получить систему, способную выполнять оптическое рассечение глубоко внутри клеток и тканей, вплоть до сотен нанометров и до мм в глубину.
В целом существует два типа конфокальных систем:
- лазерные сканирующие конфокальные микроскопы (или точечные сканеры),
- конфокальные микроскопы с вращающимся диском (или многоточечные конфокальные микроскопы).
И лазерные сканирующие, и вращающиеся дисковые конфокальные системы обеспечивают оптическое разделение, увеличивая соотношение сигнал/шум изображения, и позволяют визуализировать более глубокие слои клеток и тканей по сравнению с широкопольными системами.
Тем не менее, системы с вращающимся диском обеспечивают более высокую скорость и производительность, улучшенное соотношение сигнал/шум и более мягкую визуализацию, чем конфокальные системы с точечным сканером. По этим причинам в настоящее время технология вращающихся дисков становится предпочтительной для многих исследователей.
Деконволюция: увеличение разрешения полученного изображения
Когда свет проходит через оптические элементы любой оптической системы (например, микроскопа), он претерпевает искажения. Любая бесконечно малая точка не будет выглядеть как одна точка, и она будет излучать свет из плоскостей выше и дальше плоскости фокусировки, что приведет к размытию изображения. Этот процесс называется сверткой (конволюцией) и присущ любой оптической системе.
В свернутом изображении каждая точка объекта искажается. Искажение можно рассчитать с помощью математической функции PSF (Point Spread Function) (рисунок 6). Конечное изображение получается в результате применения PSF ко всем точкам объекта.
Хотя свертка присуща любой оптической системе, по сравнению с широкопольными системами, результирующее изображение конфокальных систем гораздо в меньшей степени подвержено свертке. Тем не менее, какая бы система ни использовалась для получения изображения, на результирующем изображении всегда будет присутствовать свертка; это означает, что на результирующем изображении всегда будет присутствовать искажение, вызванное оптикой. Чем больше расфокусированного света улавливает система, тем более искаженным будет полученное изображение. Таким образом, чем больше расфокусированного света в образце, тем более размытым будет полученное изображение.
Поскольку математика конволюции линейна, к счастью, изображение объекта может быть восстановлено, если применить обратную операцию к конволюции - этот процесс называется деконволюцией.

Рисунок 6 - Изображение PSF в 3D. Изображение показывает искажение изображения одной точки в оптической системе - Point Spread Function (PSF).
Алгоритмы деконволюции работают итерационно, повышая качество изображения. Алгоритм выдает результат при достижении заранее определенного количества итераций или заранее определенного порогового увеличения качества. К сожалению, этот итерационный процесс занимает много времени и требует больших ресурсов от центрального процессора. Чем больше изображение (крупные организмы, длинный таймлапс и т.д.), тем дольше может длиться процесс обработки, от многих часов до нескольких дней (в зависимости от набора данных).
Компания Andor внедрила ClearView-GPU в программное обеспечение для сбора и анализа изображений Fusion и Imaris. ClearView-GPU - это программное обеспечение для деконволюции на базе GPU. Деконволюция ClearView-GPU компании Andor обеспечивает результаты до 50 раз быстрее, чем методы на базе CPU, и до 10 раз быстрее, чем другие ведущие пакеты с GPU-ускорением, особенно для больших наборов данных, даже если ускорение итераций отключено.
Кроме того, в Dragonfly и BC43 деконволюция может быть активирована как часть протокола визуализации, что ускоряет процесс и позволяет получить деконволюционное изображение после завершения съемки.
Из вышесказанного вытекают два вопроса:
1. Каковы преимущества использования широкопольной визуализации и деконволюции изображения?
Важно помнить, что одним из неотъемлемых аспектов повышения соотношения сигнал/шум в конфокальном изображении является выполнение оптического секционирования путем отбрасывания расфокусированного света. Поэтому изображения, полученные с помощью конфокального микроскопа, могут требовать большего освещения, чем при использовании широкопольной системы. Это может привести к повышенному обесцвечиванию и фототоксичности. Одним из хороших вариантов для высокочувствительных образцов является получение изображений в широкопольной модальности. Полученное изображение может быть восстановлено с помощью деконволюции (Рисунок 7). Поскольку образец был не очень толстым, широкопольный режим идеально подходит для визуализации, время экспозиции, а также мощность лазера, используемая для получения изображения, могут быть значительно снижены.
Рисунок 7 – Изображение клетки млекопитающего, полученное в широкопольном режиме с помощью Andor BC43. На изображении показано широкопольное изображение до деконволюции (слева) и после деконволюции (справа). Изображение представляет собой проекцию максимальной интенсивности 35 стеков в диапазоне 7 мкм. Темно-синий-актин, пурпурный-митохондрии, желтый-микротрубочки, голубой-ДНК. Изображение Клаудии Флориндо - Andor Technology
2. Если при съемке с широким полем можно использовать меньше света и устранить размытие с помощью деконволюции, то почему бы всегда не использовать съемку с широким полем?
Как было сказано выше, и конфокальная визуализация, и визуализация широкого поля дают преимущества восстановления изображения путем деконволюции. Пользователь должен выбрать наилучший способ получения изображений, а затем применить деконволюцию к полученному изображению. Хорошими примерами являются рисунки 7 и 8. На рисунке 7 изображение Z-стека клеток млекопитающих, полученное в режиме широкого поля, выиграло от деконволюции и дало отличный результат. С другой стороны, на рисунке 8 можно наблюдать толстый хвост рыбы, полученный в широкопольном режиме и затем деконволюционированный. В данном случае очевидно, что широкое поле не является идеальным способом визуализации для этого образца.
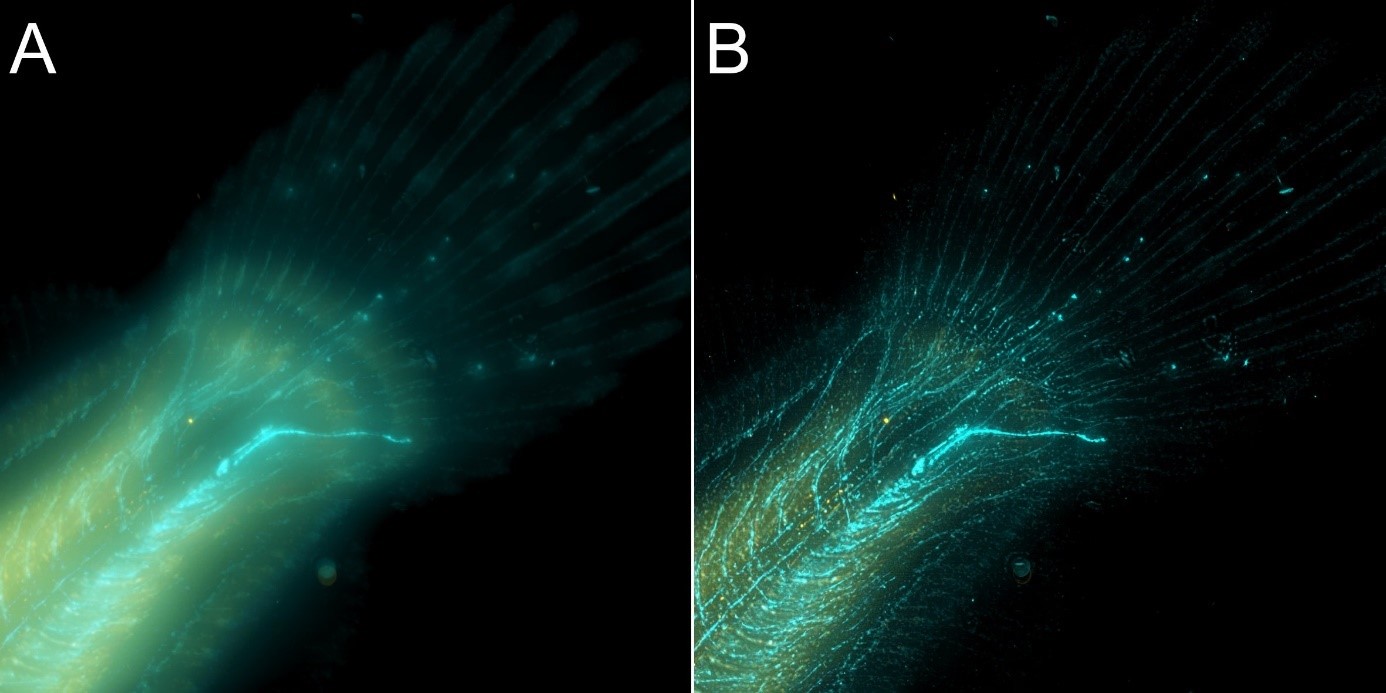
Рисунок 8 - Изображение камбалы в широкопольном режиме с использованием BC43 и деконволюцией с помощью Clear-View GPU.
На рисунке 8 представлен хвост камбалы, полученный в режиме широкопольной визуализации A) и деконволюции B). Метод широкопольной визуализации не является лучшим вариантом для изображения более толстых образцов - хотя изображение выиграло от восстановления с помощью деконволюции Clear-View на базе GPU, исходная рыба была слишком толстой для получения изображения в широкопольном режиме. Результат может быть значительно улучшен, если исходное изображение получено с использованием конфокального метода. - см. рисунок 9
Тот же участок рыбы с рисунка 8 был также исследован в конфокальном режиме и впоследствии подвергнут деконволюции - рисунок 9.
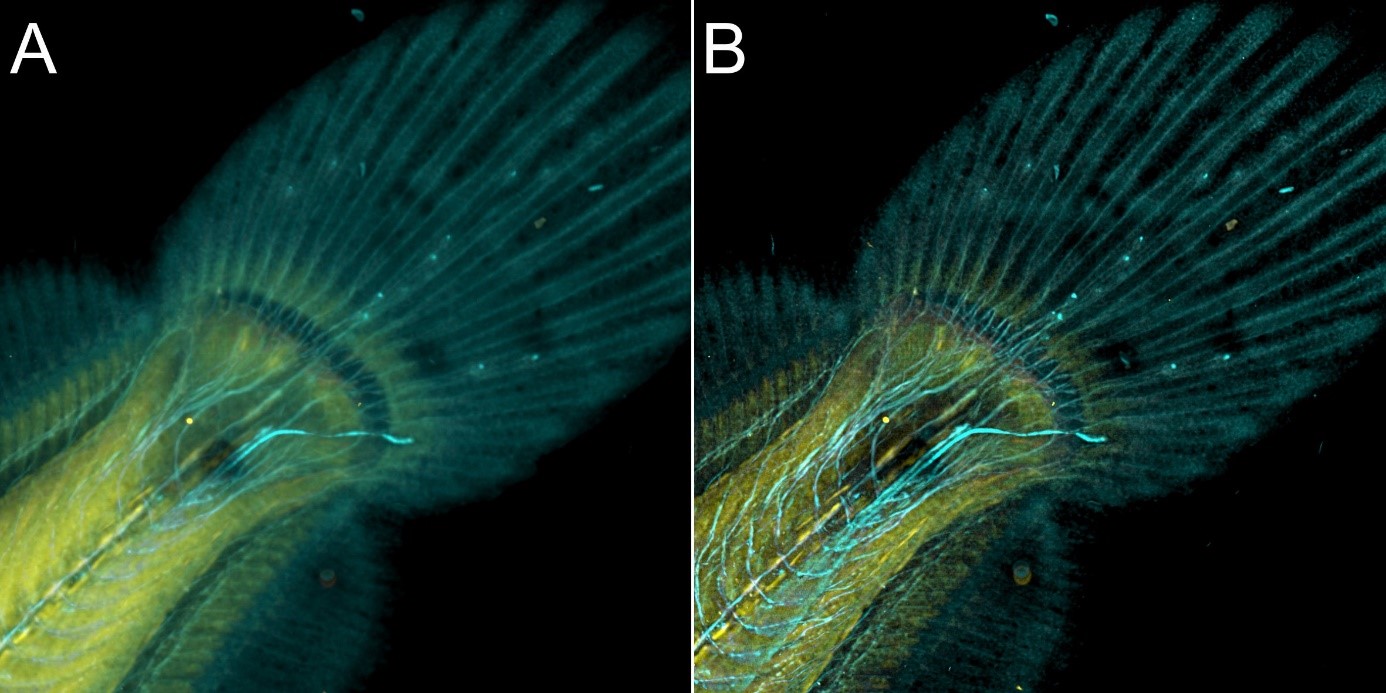
Рисунок 9 - Изображение камбалы в конфокальном режиме с использованием BC43 и деконволюцией с помощью Clear-View GPU.
На рисунке 9 хвост камбалы, полученный в режиме конфокальной визуализации A) и деконволюции B). Конфокальный режим визуализации является лучшим вариантом для получения изображений более толстых образцов, качество изображения было улучшено после деконволюции с помощью Clear-View GPU деконволюции.
Результаты, представленные на рисунках 7, 8 и 9, показывают явное преимущество деконволюции, но, как можно заметить, для более толстых образцов (>30 мкм) требуется конфокальный микроскоп с вращающимся диском для исключения расфокусированного света и получения изображения, которое лучше отображает объект.
Важно отметить, что конфокальные микроскопы Andor: BC43 и Dragonfly могут получать изображения размером от сотен микрометров до миллиметрового диапазона, а деконволюция Clear-View Deconvolution всегда повышает соотношение сигнал/шум и разрешение полученных изображений.
В целом, деконволюция - это процесс, в ходе которого искажения свертки в оптической системе математически корректируются. В результате устраняются размытость и затуманенность, которые были бы у исходного изображения. Деконволюция, таким образом, увеличивает SNR (отношение сигнал/шум) и разрешение изображения. Если система обеспечивает деконволюцию, то она всегда улучшает качество изображения.
Обзор микроскопов Andor
Компания Andor предлагает превосходные системы конфокальной визуализации, адаптированные к потребностям и приложениям различных пользователей. Запатентованные технологии Andor в разработке многоточечных конфокальных микроскопов гарантируют, что при использовании любой из систем пользователи получат преимущества:
- запатентованное равномерное освещение (Borealis);
- Высокочувствительное детектирование (EMCCD и sCMOS детекторы Andor);
- Сверхбыстрая конфокальная визуализация (скорость конфокальной съемки до 400 кадров в секунду);
- Высокое фоновое отклонение (изображение толстых образцов от 100 нм до мм).
Andor предлагает две системы конфокальной визуализации - Dragonfly и BC43.
BC43 — это высококачественная конфокальная система по доступной цене. Это прибор "все в одном", простой, компактный и чрезвычайно удобный для пользователя. BC43 — это рабочая лошадка для визуализации, которая идеально подходит для множества приложений в области наук о жизни и может поместиться в углу основного помещения или на лабораторном столе.
Dragonfly — это конфокальная система высокого класса. Dragonfly — это комплексная система визуализации, подходящая для подавляющего большинства приложений в области биологических наук; от более рутинных приложений до высококлассной сверхбыстрой визуализации - Dragonfly может обеспечить все.
Ниже приведены две таблицы, которые могут помочь вам выбрать конфокальный микроскоп, наилучшим образом отвечающий потребностям визуализации: 1) по области применения; 2) по методу визуализации.
Обратите внимание, что в таблицах указано, для каких областей применения наиболее подходят различные продукты. Однако экспериментальные требования у всех разные, пожалуйста, обсудите с нами ваши конкретные требования.
Выбор микроскопа по применению
Пояснения к обозначениям
|
|
Идеально подходит |
|
|
Подходит частично |
|
|
Не совместимо |
|
Область применения |
Эксперимент |
BC43 |
Dragonfly 200 |
Dragonfly 500 |
|
Цитология |
Внутриклеточная структура |
|
|
|
|
Клеточный цикл - деление клетки |
|
|
| |
|
Динамика микротрубочек |
|
|
| |
|
Визуализация митохондрий (фиксированные) |
|
|
| |
|
Визуализация митохондрий (живые) |
|
|
| |
|
Цитология |
Динамика мембран (например, цитокинез) |
|
|
|
|
Внутриклеточное перемещение |
|
|
| |
|
Визуализация ресничек (> 50 к/с) |
|
|
| |
|
Движение везикул |
|
|
| |
|
Ремоделирование хроматина |
|
|
| |
|
Биология развития |
Раннее развитие эмбриона |
|
|
|
|
Формирование конечностей |
|
|
| |
|
Подготовка образцов тканей |
|
|
| |
|
Парафиновые срезы |
|
|
| |
|
Целые организмы толщиной до 500 мкм |
|
|
| |
|
Целые организмы толщиной более 500 мкм (зависит от прозрачности образца) |
|
|
| |
|
Оплодотворение |
|
|
| |
|
Взаимодействие патоген-хозяин (вирус, бактерии, грибок) |
|
|
| |
|
Внутриклеточное перемещение |
|
|
| |
|
Движение везикул |
|
|
| |
|
Органоиды толщиной до 500 мкм |
|
|
| |
|
Органоиды толщиной более 500 мкм (зависит от прозрачности образца) |
|
|
| |
|
Исследования кровотока |
|
|
| |
|
Биология рака |
Крупные срезы ткани |
|
|
|
|
Визуализация движения и деления живых клеток |
|
|
| |
|
Инвазия in vitro |
|
|
| |
|
Органоиды толщиной до 500 мкм |
|
|
| |
|
Органоиды толщиной более 500 мкм |
|
|
| |
|
Иммунология, заболевания |
Фиксированные образцы |
|
|
|
|
Большие образцы толщиной до 500 мкм |
|
|
| |
|
Большие образцы толщиной больше 500 мкм |
|
|
| |
|
Высокоскоростная визуализация живых клеток |
|
|
| |
|
Кровоток |
|
|
| |
|
Микробиология |
Внутриклеточная структура (сверхвысокое разрешение по технологии SRRF-Stream) |
|
|
|
|
Внутриклеточная структура - Молекулярные взаимодействия (сверхвысокое разрешение по технологии dSTORM) |
|
|
| |
|
Динамика инфекции на поверхности клеток (с использованием технологии TIRF) |
|
|
| |
|
Нейронауки |
Культура тканей (живых и фиксированных) |
|
|
|
|
Секционирование тканей (живых и фиксированных) |
|
|
| |
|
Визуализация целого мозга (толщиной до 500 мкм) |
|
|
| |
|
Визуализация целого мозга толщиной 500 мкм + (зависит от прозрачности образца) |
|
|
| |
|
Визуализация кальция (волны до 40 кадров в секунду) |
|
|
| |
|
Визуализация кальция (волны, искры > 40 кадров в секунду) |
|
|
| |
|
Живой везикулярный транспорт |
|
|
| |
|
Визуализация одиночных молекул в реальном времени |
|
|
| |
|
Конус роста |
|
|
| |
|
Локализация и рециркуляция рецепторов |
|
|
| |
|
Биофизика |
Белково-белковые взаимодействия |
|
|
|
|
Динамика белковых мембран |
|
|
| |
|
Транспорт одиночного белка |
|
|
| |
|
Эндо- и экзоцитоз |
|
|
| |
|
Сверхразрешение на основе локализации |
|
| ||
|
Расширяющая микроскопия |
|
|
| |
|
Мультиплексная визуализация - транскриптомика с пространственным разрешением |
|
|
| |
|
Мультиплексная визуализация - Протеомика с пространственным разрешением |
|
|
| |
Выбор микроскопа по способу визуализации
|
Метод |
Технология |
BC43 |
Dragonfly 200 |
Dragonfly 500 |
|
Микроскопия в проходящем свете |
Дифференциальный фазовый контраст
|
✘ |
✘ |
✘ |
|
Фазовый контраст |
✘ |
✔ |
✔ | |
|
Дифференциальный интерференционный контраст
|
✘ |
✔ |
✔ | |
|
Широкопольная визуализация |
До 4 каналов |
✔ |
✔ |
✔ |
|
Больше 4 каналов |
✘ |
✔ |
✔ | |
|
Одновременный захват с двух камер |
✘ |
✔ |
✔ | |
|
Конфокальная визуализация |
Единичный пинхол |
✔ |
✔ |
✔ |
|
Два пинхола |
✘ |
✔ |
✔ | |
|
Одновременный захват с двух камер |
✘ |
✔ |
✔ | |
|
До 4 каналов |
✔ |
✔ |
✔ | |
|
Больше 4 каналов |
✘ |
✔ |
✔ | |
|
Визуализация образцов до 500 мкм |
✔ |
✔ |
✔ | |
|
Визуализация образцов больше 500 мкм |
Может быть доступно |
✔ |
✔ | |
|
Специализированная микроскопия |
TIRF |
✘ |
✘ |
✔ |
|
dSTORM |
✘ |
✘ |
✔ | |
|
3D-STORM |
✘ |
✘ |
✔ | |
|
Режим визуализации |
Плоская (2D) |
✔ |
✔ |
✔ |
|
Объёмная (3D) |
✔ |
✔ |
✔ | |
|
Деконволюция |
✔ |
✔ |
✔ | |
|
Пространственные тайлы |
✔ |
✔ |
✔ | |
|
Multi-Well |
✔ |
✔ |
✔ | |
|
Сшивание |
✔ |
✔ |
✔ | |
|
3D-Сшивание |
✔ |
✔ |
✔ | |
|
Детектор |
sCMOS |
✔ |
✔ |
✔ |
|
EMCCD |
✘ |
✔ |
✔ | |
|
Прочее |
БИК до 780нм |
✘ |
✔ |
✔ |
|
Компактность |
✔ |
|
| |
|
Температурный контроль |
✔ |
✔ |
✔ | |
|
Многопозиционность |
✔ |
✔ |
✔ | |
|
Тайм-лапс |
✔ |
✔ |
✔ |