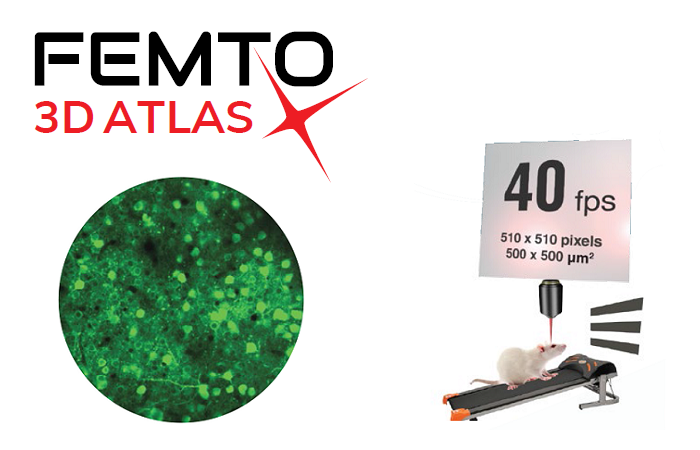
Визуализация белковых комплексов на молекулярном уровне интересовала исследователей в области естественных наук на протяжении десятилетий, но была недоступна. С появлением наноскопии MINFLUX это стало возможным.
MINFLUX может разрешать индивидуально переключаемые флуорофоры на расстояниях от 1 до 2 нм. Это достигается путем локализации одиночных флуорофоров с паттерном возбуждения, характеризующимся пространственно контролируемым нулем интенсивности, например, формой donut или “bottle-beam”. Нулевая интенсивность этого пучка возбуждения затем используется для зондирования флуорофора в заранее определенных местах, близких к его фактическому положению. Положение флуорофора может быть определено с минимальным числом фотонов и, следовательно, в пространственно-временном режиме, значительно превосходящем альтернативные методы [2-7].
• MINFLUX локализует одиночные фотонные излучатели, минимизируя излучение фотонов
• Обеспечивает точность локализации до 1 нм. Для 2D <2 нм, для 3D < 3 нм
MINFLUX может использовать как основу обычный флуоресцентный микроскоп. Вместе с возможностью многоцветной визуализации MINFLUX предлагает ученым идеальный инструмент для решения многочисленных биомедицинских и биофизических вопросов в молекулярном масштабе.
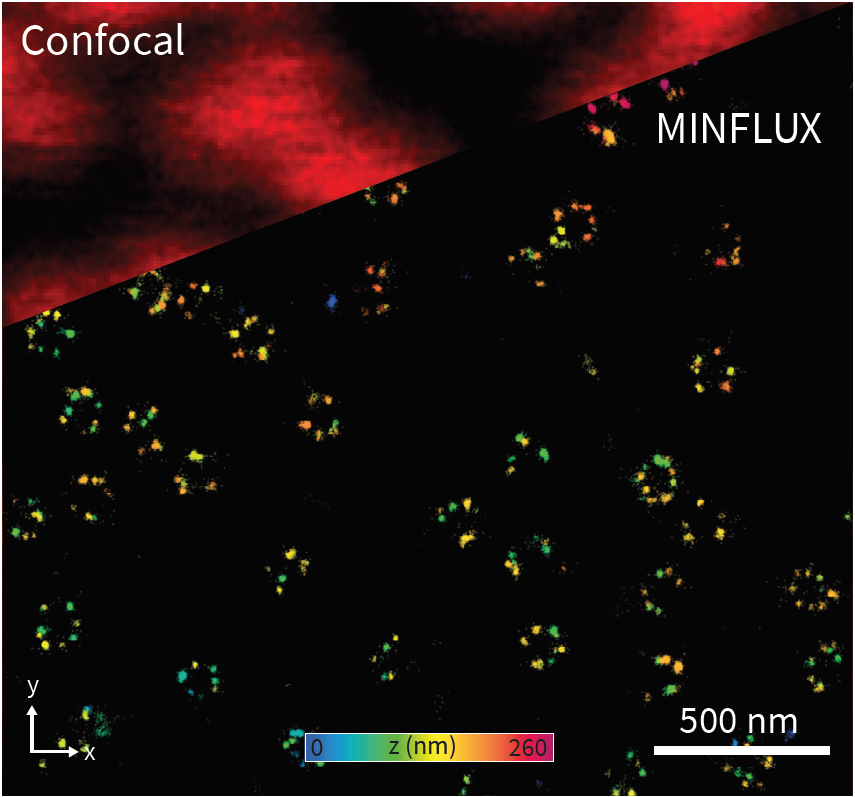
Рис. 1. Конфокальные и 3D-изображения MINFLUX образца ядерного порового комплекса.
Флуоресцентная микроскопия и концепция MINFLUX
Флуоресцентная микроскопия широко используется в исследованиях, диагностике и биомедицинской визуализации. Она обеспечивает неинвазивную многомерную визуализацию структур и молекул и поэтому идеально подходит для исследования биомедицинских образцов. К сожалению, разрешение обычных световых микроскопов ограничено половиной длины волны [8]. В последние несколько десятилетий было разработано несколько подходов к преодолению этого предела [9-17].
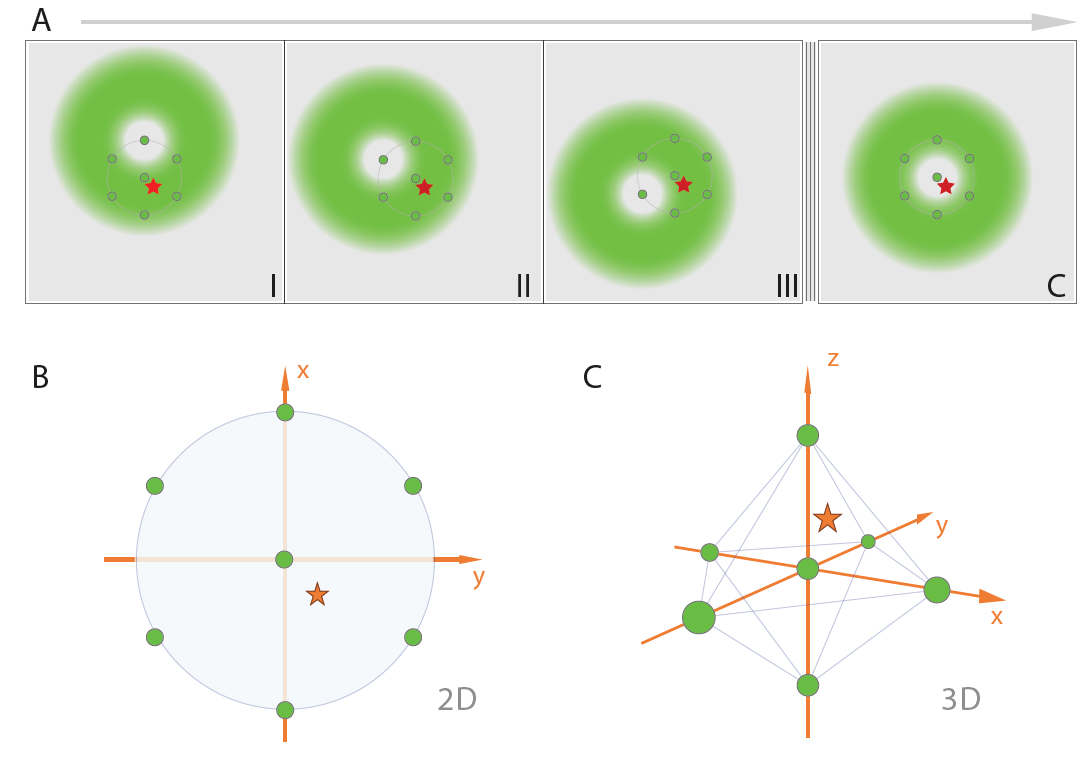
Рис. 2. Схема сканирования MINFLUX.
(А) MINFLUX использует пучок возбуждения в форме donut для быстрой локализации отдельных флуорофоров, когда они находятся в флуоресцентном состоянии. Для этого флуоресценцию зондируют на заранее определенных позициях вокруг флуорофора в излучающем состоянии. (B) Для 2D MINFLUX используется гексагональный паттерн с центральной точкой для зондирования позиций с помощью пучка возбуждения в форме donut. (C) Для 3D MINFLUX используется 3D-donut то есть полый шар света, вместе с октаэдрическим паттерном в качестве зондирующего рисунка. Обозначения: красная звезда - флуорофор; зеленый круг - положение зондирования; I, II, III, C - зондирующие позиции.
В отличие от методов одномолекулярной локализационной микроскопии (SMLM) на основе камер [9-17], MINFLUX-это метод лучевого сканирования, в котором положения флуорофоров определяются с помощью предопределенных шаблонов сканирования, окружающих каждый флуорофор (рис. 2).
Для точного определения локализации флуорофора используется несколько итераций. На каждой последовательной итерации зондирующий паттерн повторно центрируется на самой последней расчетной локализации флуорофора, и диаметр зондирующего паттерна сужается, раз за разом увеличивая точность получаемых данных. Таким образом используется меньшее число фотонов.
MINFLUX для биомедицинских и биофизических применений
Микроскоп MINFLUX от Abberior был разработан как готовая система для применения в биомедицинских и биофизических областях. MINFLUX работает на базе моторизированного исследовательского микроскопа с функциями пропускания и эпифлуоресценции (рис. 3). Система предлагает множество стандартных конфокальных функций, несколько линий возбуждения: 405 нм, 488 нм, 516 нм, 640 нм, несколько каналов обнаружения: для DAPI, GFP, Cy3 или Cy5, конфокальный лучевой сканер с большим полем зрения и моторизованный пинхол. Графический интерфейс позволяет задавать заранее установленные режимы обработки изображений.
MINFLUX содержит пространственный модулятор света для формирования пучка возбуждения, сверхбыстрый (>100 кГц) сканер пучка на основе электрооптических дефлекторов для позиционирования пучка по осям XY, деформируемое зеркало для позиционирования в 3D. Для достижения точности локализации в нанометровом масштабе необходима активная стабилизация положения образца. Поэтому в систему входит блок стабилизации на основе отражения, который стабилизирует положение образца в x, y и z с точностью < 1 нм (среднеквадратичное значение), гарантируя стабильные измерения даже в течение длительного времени получения изображения.

Рисунок 3. Abberior MINFLUX на базе моторизованного исследовательского микроскопа, удобный для использования в биомедицине и биофизике.
Микроскоп Abberior MINFLUX позволяет удобный рабочий процесс. Образец позиционируется в режиме эпифлуоресценции, выполняется конфокальное (многоцветное) обзорное сканирование для точного позиционирования образца и выбора области интереса (ROI).
Флуорофоры для MINFLUX визуализации
В зоне зондирования в момент локализации должен находиться только один флуорофор в возбужденном состоянии. В настоящее время для обеспечения этого используются две стратегии:
Для визуализации фиксированных клеток может быть применена стохастическая стратегия переключения, сравнимая с (d)STORM [12,13]. Для этого используются органические красители в сочетании с буферными системами и реагентами, которые позволяют переключать электроны флуорофора между возбужденным и невозбужденным состояниями. В наиболее ярком примере карбоцианиновый краситель Alexa Fluor 647 применяется вместе с кислородпоглощающим GLOX -буфером и тиолами, такими как β-меркаптоэтиламин (MEA), в качестве мерцающих соединений [13]. Эти тиолы могут связываться с ядром красителя и тем самым переводить его в электроны невозбужденное состояние. Переход в излучающее состояние может происходить спонтанно или может быть вызван ультрафиолетовым излучением. Отсутствие кислорода уменьшает обесцвечивание и самопроизвольное мерцание красителей, поддерживая контроль кинетики мерцания по интенсивности УФ-излучения. Эта стратегия была успешно использована в MINFLUX для различных красителей, возбуждаемых при 640 нм, таких как Alexa Fluor 647, CF660C, CF680 или sCy5 [1-7].
Вторая стратегия сопоставима с той, которая используется для PALM [14,15]. Эта стратегия основана на фотоактивируемых или фотоконвертируемых флуорофорах (органических красителях/ флуоресцентных белках), которые могут быть переключены между состояниями или переключены с одной длины волны излучения на другую с помощью световых реакций на основе фотоконверсии. Этот подход был успешно применен в недавней публикации [3], где фотоконвертируемый флуоресцентный белок mMaple использовался в качестве метки при MINFLUX визуализации ядерных поровых комплексов.
Способы маркировки для визуализации MINFLUX
Было использование несколько способов маркировки образцов для MINFLUX [1-7]. Широко применяемым и надежным методом мечения биомолекул и структур, представляющих интерес для фиксированных образцов, является непрямое иммуномечение. Этот метод является очень хорошей отправной точкой для проверки пригодности конкретного образца. Еще лучшие результаты могут быть достигнуты с использованием меньших меток [18], например, меньших комплексов антител, непосредственно меченых антител или нанотел. Мечение с помощью SNAP - или Halo-меток также является хорошей альтернативой для уменьшения размера метки [1, 2, 7]. Будущие разработки в области клик-химии и неканонических аминокислот, вероятно, обеспечат дополнительные стратегии мечения с минимальным размером метки.
Образцы ядерного порового комплекса как эталон для MINFLUX наноскопии
Было показано, что MINFLUX наноскопия достигает беспрецедентного разрешения [1,7]. Она облегчает решение научных вопросов, которое до сих пор были недоступно. Чтобы оценить эффективность сверхразрешающих микроскопов для биомедицинских и биофизических применений, был предложен ядерный поровый комплекс в качестве четко определенного контрольного образца для биомедицинских исследований [19]. Октагонально симметричный ядерный поровый комплекс является одним из крупнейших белковых комплексов внутри эукариотических клеток. Он состоит из цитоплазматического и нуклеоплазматического кольца, которые разделены расстоянием приблизительно равным 50 нм. Общий диаметр колец NUP составляет около 125 нм.

Рис. 4. 2D и 3D наноскопия MINFLUX субъединиц ядерного порового комплекса. NUP96-SNAP/SNAP-Alexa Fluor 647 подходят в качестве эталонных структур для тестирования световых сверхразрешающих микроскопов.
(А, А’) В отличие от конфокальной микроскопии, 2D MINFLUX позволяет визуализировать форму и расположение отдельных субъединиц ядерного порового комплекса. Использование порогового значения в 150 фотонов позволяет достичь точности локализации ~2 нм для необработанных данных. (B, B’) Кроме того, 3D MINFLUX облегчает визуализацию на молекулярном уровне во всех измерениях. В осевом направлении в исходных данных достигнута точность локализации ~2.5 нм. Шкала 500 нм.
Эффективность MINFLUX была проверена с помощью клеток, экспрессирующих NUP96-SNAP, меченных Alexa Fluor 647. Как показано на рис. 4А, 2D-режим MINFLUX способен разрешать кольца NUP96 в ядерной оболочке диаметром ~110 нм. Одиночные флуорофоры были локализованы с точностью ~2 нм (в исходных данных локализации с использованием порогового значения 150 фотонов). Оценка точности локализации с использованием более высокого порога фотонов приводит к точности локализации < 1 нм (по осям xy). Эти результаты согласуются со значениями, приведенными в работах [2, 19].
Режим 3D MINFLUX также позволял визуализировать кольца меченых белков NUP96-SNAP (рис. 4В). Особенно на боковом снимке (рис. 4В’) видны две плоскости меченых белков NUP96-SNAP, которые отражают цитоплазматическое и нуклеоплазматическое кольца ядерных поровых комплексов. Линейный профиль в осевом направлении показывает точность локализации ~2,5 нм (в исходных данных локализации используется пороговое значение 150 фотонов). Оценка точности локализации с использованием более высокого порога фотона приводит к точности локализации ~2 нм (по оси z).
Для двухцветной MINFLUX визуализации может быть использован радиометрический подход к визуализации [2, 17]. Образцы готовятся с использованием двух красителей, которые могут возбуждаться с одной и той же длиной волны, но излучать на разных длинах волн. Флуоресценция регистрируется с использованием двух спектрально разделенных каналов детектирования, так что локализации могут быть назначены соответствующему флуорофору. На практике краситель с максимумом излучения при ~665 нм (например, Alexa Fluor 647) сочетается с красителем с максимумом излучения со смещением в красный цвет (например, CF680; em, max = 700 нм).
Чтобы оценить эффективность MINFLUX для двухцветной визуализации, образцы NUP96-SNAP/ SNAP-Alexa Fluor 647 были дополнительно помечены агглютинином зародышей пшеницы (WGA), конъюгированным с CF680. Этот реагент связывается с гликопротеинами в центре ядерных пор. При использовании двухцветной визуализации MINFLUX кольца, образованные NUP96, стали видны вместе с очень маленьким кольцом или точкой в центре поры (рис.5). Как показал этот эксперимент, двухцветный MINFLUX позволяет визуализировать две структуры, находящиеся в очень тесной пространственной взаимосвязи.
Визуализационные характеристики MINFLUX Abberior идентичны стендовым установкам, описанным ранее [1-4, 6]. Образцы ядерного порового комплекса демонстрируют идеализированную ситуацию для визуализации MINFLUX, то есть они являются хорошо определенными структурами, с установленными способами мечения, основанными на наиболее эффективных флуорофорах, и на очень маленьких метках, то есть SNAP-меченых белках и метках. Следующие примеры продемонстрируют возможности технологии MINFLUX для более сложных образцов.
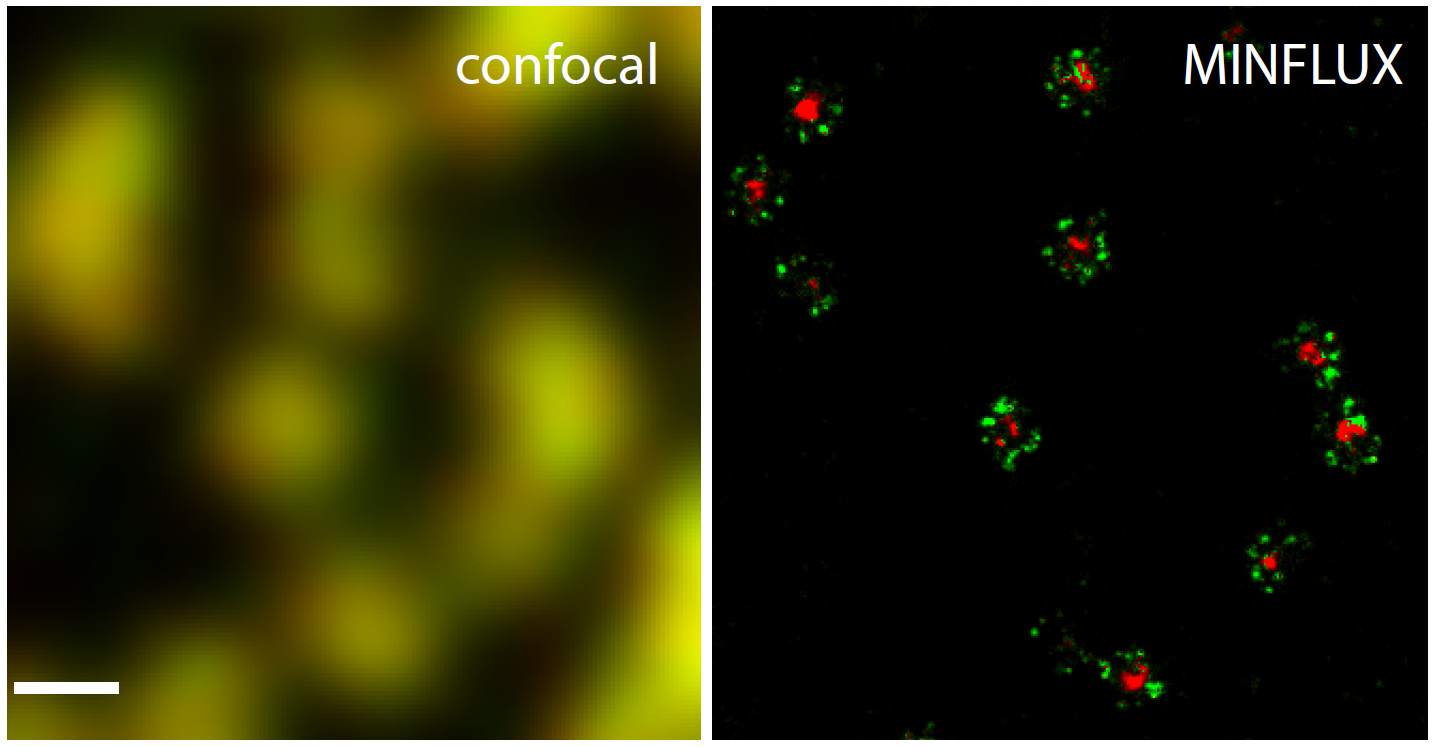
Рис. 5. Двухцветная MINFLUX наноскопия ядерного порового комплекса.
Фиксированные клетки NUP96-SNAP были мечены SNAP-Alexa Fluor 647 (зеленый) и WGA-CF680 (красный) и визуализированы в конфокальном режиме в 2D. Двухцветный 2D-MINFLUX был выполнен с использованием стратегии радиометрического обнаружения. Как и на одноцветных изображениях, NUP96 был обнаружен в кольцах в ядерной оболочке. Далее во втором канале видно окрашенное гликопротеиновое ядро. Шкала 200 нм. Показаны необработанные данные локализации.
Визуализация MINFLUX в образцах органелл
Биология органелл довольно важная область. Хотя клеточные органеллы хорошо исследованы, многие значимые аспекты, касающиеся расположения и динамики мембранных белков или физиологических реакций, все еще не изучены, поскольку органеллы имеют малый размер. Микроскоп MINFLUX Abberior - идеальный инструмент для решения этих вопросов. Ниже были выбраны два примера из биологии органелл, чтобы проиллюстрировать преимущества MINFLUX.
Первый пример связан с митохондриальной биологией. Митохондрии играют решающую роль в жизни, болезнях и смерти. Митохондрии имеют диаметр ~300 нм и обладают двумя мембранами, содержащими большой набор мембранных белков в качестве функциональных единиц. Митохондриальный матрикс содержит митохондриальный геном, называемый мтДНК [20]. В этом примере две метки с очень разной плотностью мечения были объединены, чтобы проверить, работает ли двухцветный MINFLUX в этих условиях. Для этого митохондриальный импортный рецептор TOM20 во внешней мембране митохондрий и нуклеоиды мтДНК были мечены методом непрямой иммунофлуоресценции с использованием sCy5 и CF680 (рис. 6). Используя описанный выше метод двухцветной визуализации MINFLUX, удалось локализовать отдельные флуорофоры в митохондриях, показав, что иммуномеченные образцы могут быть визуализированы даже при очень высокой плотности флуорофоров. Далее удалось выделить эти метки и визуализировать единичные кластеры TOM20 диаметром всего 8-15 нм вместе с плотно упакованными нуклеоидами мтДНК (средний диаметр ~100 нм).
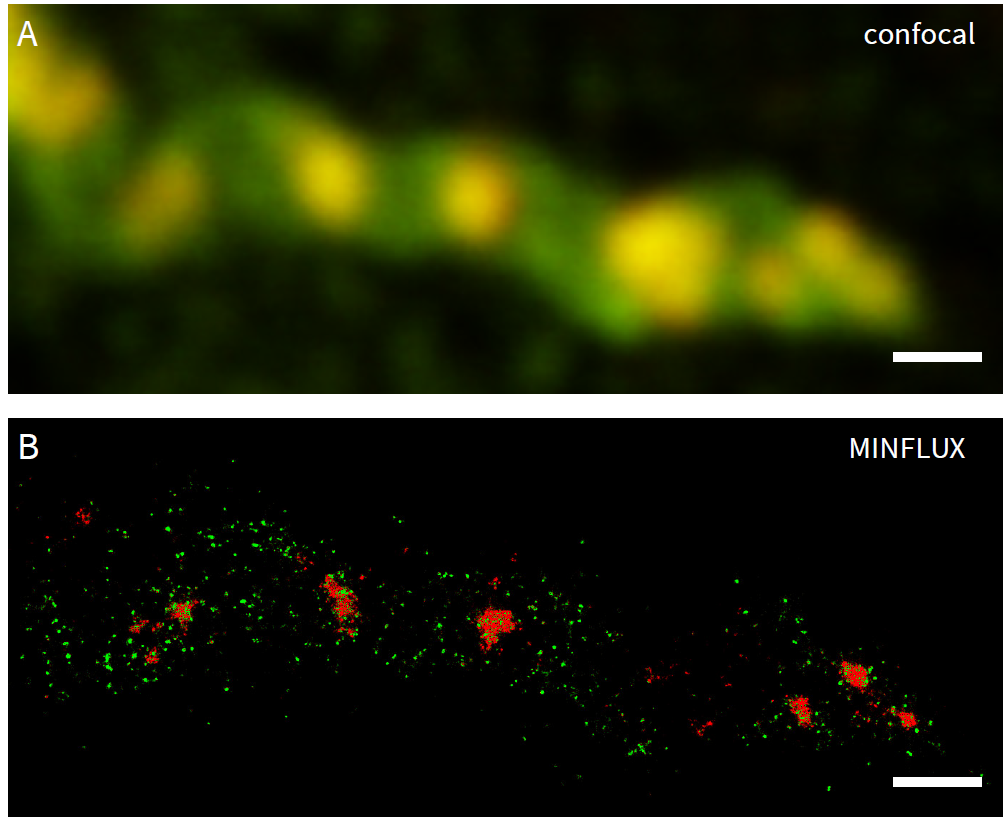
Рис. 6: Двухцветный MINFLUX на образцах митохондрий.
Митохондриальный белок TOM20 (зеленый) и мтДНК (красный) были мечены в клетках млекопитающих непрямой иммунофлуоресценцией с использованием вторичных антител, связанных с sCy5 и CF680. Двухцветная конфокальная визуализация (А) и MINFLUX (В) проводились с использованием радиометрической стратегии обнаружения. Обратите внимание, что плотность мечения обеих структур сильно отличается. MINFLUX позволяет визуализировать и разделять обе структуры. Шкала 500 нм.
В качестве второго примера отдельные белки в пероксисомах были визуализированы с помощью MINFLUX. Пероксисомы - это очень маленькие клеточные органеллы диаметром всего ~100 нм. Для визуализации MINFLUX пероксисомный мембранный белок PMP70 был мечен непрямой иммунофлуоресценцией с использованием Alexa Fluor 647. В режиме 2D MINFLUX было обнаружено большое количество локализаций в пероксисомах, что еще раз иллюстрирует, что с помощью MINFLUX можно успешно визуализировать не только неплотно меченые образцы, но и плотные структуры (рис. 7А). Это относится также к 3D MINFLUX наноскопии (рис. 7Б). 3D-данные показывают большое количество локализаций у пероксисомы и позволяют оценить трехмерную форму и распределение PMP70 внутри каждой пероксисомы.
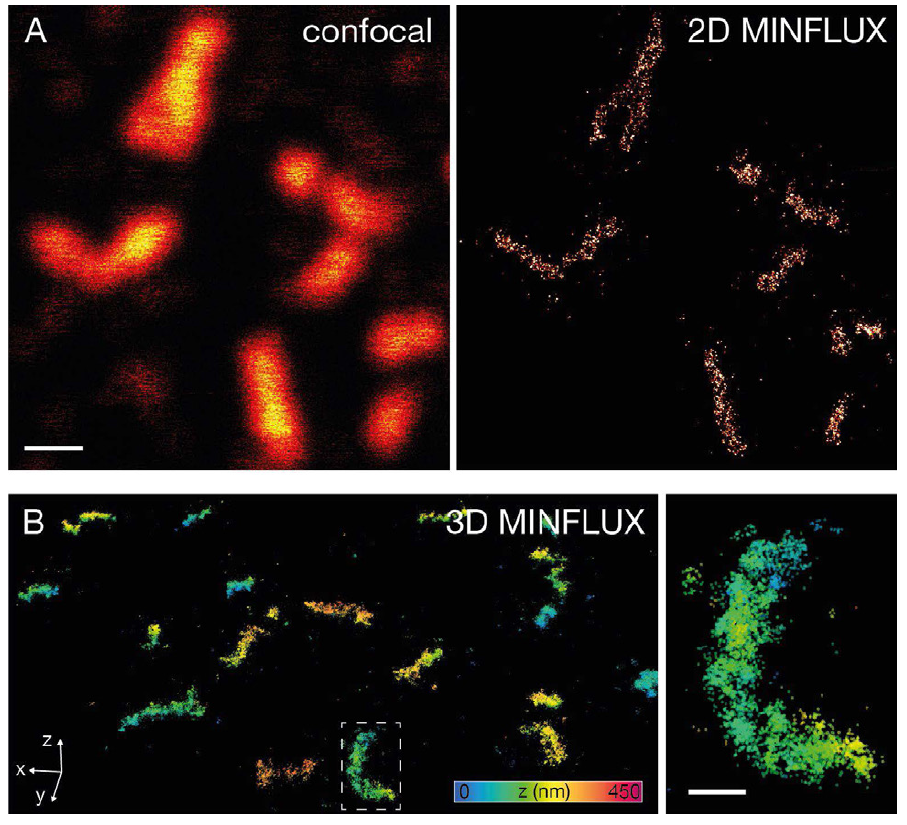
Рис. 7. MINFLUX визуализация пероксисомных образцов.
Для визуализации пероксисом клетки млекопитающих фиксировали и метили первичными антителами для PMP70 и вторичными антителами, связанными с Alexa Fluor 647. (А) Конфокальное и MINFLUX изображение показывает, что, несмотря на высокую плотность мечения, пероксисомы могут быть изображены с помощью MINFLUX. (В) В дополнение к этому 3D MINFLUX позволил визуализировать форму пероксисом в 3D. Отображаемый набор данных имеет боковой размер 7,2 х 8,5 мкм. Изображение справа представляет собой увеличение прямоугольной зоны на рисунке В. Шкала: 500 нм (А), 200 нм (Б)
Визуализация MINFLUX нейробиологических образцов
Ожидается, что разрешающие возможности MINFLUX раздвинут границы и для многочисленных приложений визуализации в нейробиологии. Чтобы проиллюстрировать возможности 2D и 3D наноскопии MINFLUX для применения в нейробиологии, была выбрана хорошо известная тестовая структура из нейробиологии под названием βII спектрин в первичных нейронах. Спектрины - это мембраносвязанные каркасы и актин-связывающие белки, которые образуют периодическую решетку с расстояниями около 190 нм вдоль аксонов [21]. Эти цитоскелетные сети играют важную роль в формировании и структурной организации нейронов. βII спектрин в первичных нейронах гиппокампа окрашивали Alexa Fluor 647 с помощью непрямого иммуномечения. 3D MINFLUX четко выявил периодическое расположение βII-спектра в аксоне (рис. 8) с точностью локализации в нанометровом масштабе.
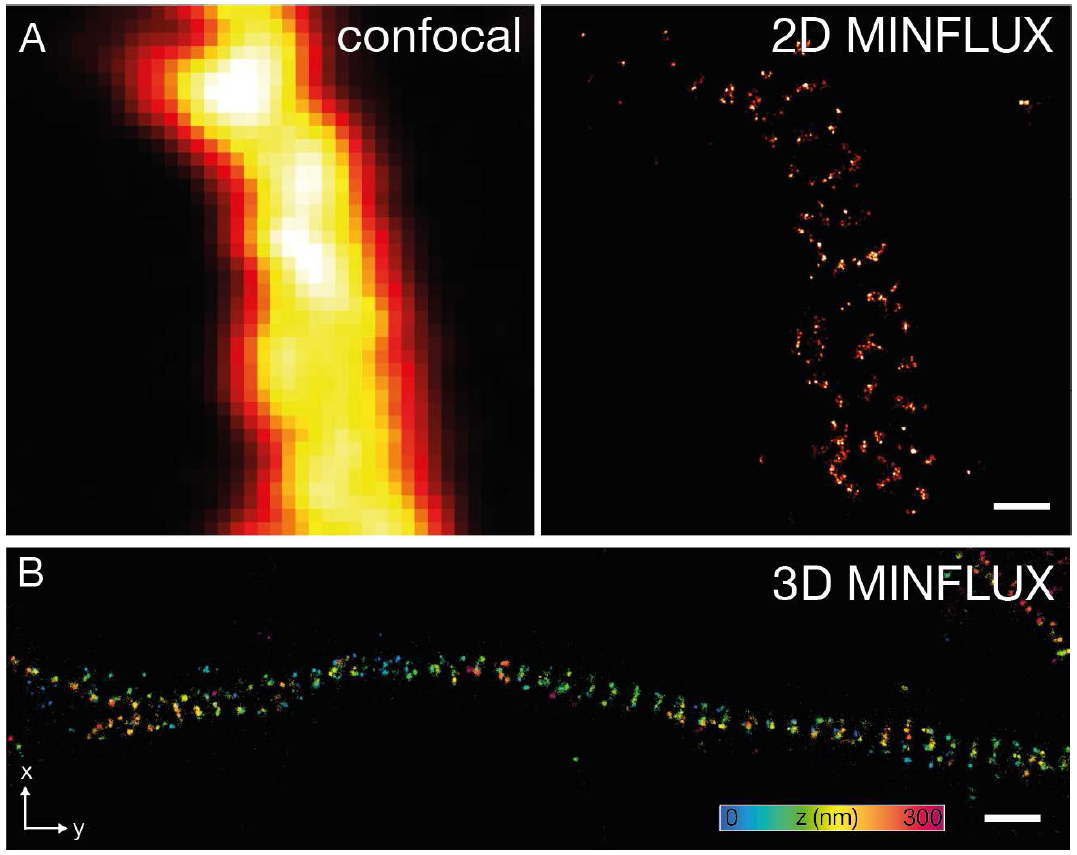
Рис. 8: MINFLUX визуализация нейробиологических образцов.
(А) 2D MINFLUX и (В) 3D MINFLUX визуализация βII спектра в первичном нейроне гиппокампа, меченном Alexa Fluor 647 методом непрямой иммунофлуоресценции, вид сверху. Шкала: 500 нм.
Заключение
Микроскоп MINFLUX Abberior - это система "под ключ" со встроенной 3D-стабилизацией, которая делает уникальные возможности MINFLUX доступными для широкого круга исследователей. Системы MINFLUX Abberior поставляются с функцией конфокальной микроскопии и могут быть модернизированы для методов, таких как STED-микроскопия. 2D-и 3D-наноскопия MINFLUX обеспечивает разрешение молекулярного масштаба в биомедицинских образцах, позволяя визуализировать субклеточные структуры, которые не могут быть визуализированы с помощью альтернативных методов флуоресцентной микроскопии. Двухцветный MINFLUX дает информацию о локализации двух белков по отношению друг к другу и об их распределении с высоким разрешением. Таким образом, наноскопия MINFLUX будет способствовать новому пониманию биологических и биомедицинских проблем.